
鸡蛋壳的主要成分是碳酸钙,为了测定鸡蛋壳中碳酸钙的含量,小丽称取30g干燥的碎鸡蛋壳放入烧杯中,并向其中加入了80g稀盐酸恰好完全反应(假设鸡蛋壳中除碳酸钙外的其他成分都不溶于水,且不与稀盐酸反应),反应后烧杯中物质的总质量为101.2g。我能完成下列计算:
⑴碳酸钙的质量;
⑵当碳酸钙恰好完全反应时所得溶液中溶质的质量分数。(结果保留一位小数)
(1)20g (2)24.3%
解析试题分析:根据质量守恒定律得知反应生成的二氧化碳的质量,再根据二氧化碳的质量,运用化学方程式计算的碳酸钙质量和生成的氯化钙质量,再根据反应溶液的质量计算出所得溶液的溶质质量分数
根据质量守恒定律,生成二氧化碳的质量为80g+30g-101.2g=8.8g
(1)设30g鸡蛋壳中碳酸钙的质量为X,生成氯化钙的质量为Y。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
X Y 8.8g
100:44=X:8.8g X=20g
(2) 111:44=Y:8.8g Y= 22.2g
所得溶液质量为101.2-(30-20)=91.2g
所得溶液中溶质的质量分数=22.2/91.2×100%=24.3%
答:⑴30g鸡蛋壳中碳酸钙的质量为20g。⑵所得溶液中溶质的质量分数为24.3%。
考点:质量守恒定律及根据化学方程式的计算和溶液的综合计算能力考查。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:初中化学 来源: 题型:计算题
侯氏制“碱”法制得的纯碱中含有少量氯化钠。请根据下图所示的实验过程和提供的数据,回答下列问题: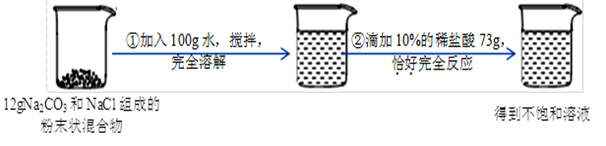
(1)在滴入稀盐酸的过程中,观察到的明显现象是 。
(2)该反应过程中生成CO2气体的质量.
(3)求最终所得溶液中溶质的质量是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
金属镁可用于火箭、飞机、轮船的制造。镁在现代材料工业中需求量逐渐增大。海水中含有约0.129%的镁元素,仅次于氯化钠,总储量约1 800亿吨,开发潜力很大。
(1)在提取镁的生产过程中,需要浓缩海水,提高海水中氯化镁的质量分数,你认为既环保又经济的方法是 ;
(2)浓缩海水中MgCl2的质量分数为9.5%,求要将150吨浓缩海水中MgCl2都转化为Mg(OH)2,理论上需要Ca(OH)2多少吨?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
用“侯氏联合制碱法”制取的纯碱(Na2CO3)中常含有少量的氯化钠。化学实验小组同学为测定某厂生产的纯碱中碳酸钠的含量,称取12 g样品放入烧杯中并滴加稀盐酸,当盐酸滴加至73 g时,气泡不再冒出,此时称得烧杯内溶液的总质量为80.6 g。
试计算:
(1)产生二氧化碳气体的质量是 g。
(2)该厂生产的纯碱中碳酸钠的质量分数。(计算结果精确到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
已知金属钠和水能发生下列反应:
2Na+2H2O=2NaOH+H2↑,现将一定质量的金属钠放入75.6克水中,反应后生成8克氢氧化钠,计算:
(1)参加反应的水是多少克?
(2)反应后得到的氢氧化钠溶液中溶质的质量分数是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某兴趣小组在实验室中用氯酸钾制取氧气,实验测得相关数据如下图所示:
(1)反应生成氧气质量为 g。
(2)计算剩余的混合物中二氧化锰的质量(计算结果保留二位小数)。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
如图是某工业用食盐产品质量指标.为了测定其中氯化钠的质量分数,取100g该工业用食盐进行实验:①测得水的质量为3.36g;②用碳酸钠来测定杂质氯化钡的质量时,得到0.985g沉淀(化学方程式为:BaCl2+Na2CO3=BaCO3↓+2NaCl).
求:(1)100g该工业用食盐中含BaCl2的质量.
(2)请计算此工业用食盐中氯化钠的质量分数是多少?并判断该工业用食盐是否符合产品质量指标.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com