
| 各物质的质量 | 第一个烧杯 | 第二个烧杯 |
| 石灰石样品质量 | 12g | 12g |
| 稀盐酸质量 | 50g | 100g |
| 烧杯残留物质量 | 58.7g | 107.6g |
| 产生的CO2质量 | - | - |
分析 碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应前后的质量差即为反应生成二氧化碳的质量,根据二氧化碳的质量可以计算碳酸钙的质量,进一步可以计算石灰石样品中CaCO3的质量分数.
解答 解:(1)第一个烧杯中产生二氧化碳的质量为:12g+50g-58.7g=3.3g,
第二个烧杯中产生二氧化碳的质量为:12g+100g-107.6g=4.4g,
填表如下:
| 各物质的质量 | 第一个烧杯 | 第二个烧杯 |
| 石灰石样品质量 | 12g | 12g |
| 稀盐酸质量 | 50g | 100g |
| 烧杯残留物质量 | 58.7g | 107.6g |
| 产生的CO2质量 | 3.3g | 4.4g |
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,同时考查了分析表中数据的能力,计算时要注意规范性和准确性.


科目:初中化学 来源: 题型:选择题
| 元素信息 | 元素名称 | |
| A | 这种元素在地壳中含量第一 | 铝 |
| B | 存在于人体骨骼中,缺乏该元素会发生骨质疏松 | 钠 |
| C | 这种元素在空气中含量第一 | 氧 |
| D | 常见的金属元素,人体缺乏该元素会导致贫血 | 铁 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
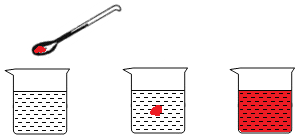 肖红同学在研究分子的性质时,做如如图所示实验.在一个小烧杯里放半杯水,然后用药匙取一小粒品红,放入烧杯.
肖红同学在研究分子的性质时,做如如图所示实验.在一个小烧杯里放半杯水,然后用药匙取一小粒品红,放入烧杯.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
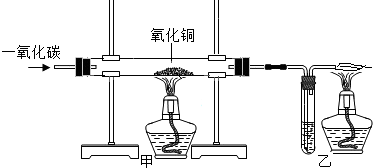
| 反应前 | 氧化铜完全反应后 | |
| Ⅰ组 | 洗气瓶和石灰水的质量为185g | 洗气瓶和瓶内物质的总质量为187g |
| Ⅱ组 | 玻璃管和氧化铜样品的质量为57.9g | 玻璃管和玻璃管内物质的质量为56.1g |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 有利的一面 | 不利的一面 | |
| 示例:CO2 | 可以用于人工降雨 | 导致“温室效应” |
| 酸 | 是工业生产中重要的原料 | 但它又容易混入工业废水中对环境造成污染 |
| 碱 | 可以用于造纸工业 | 但是氢氧化钠具有强烈的腐蚀性,含有氢氧化钠的废水会污染环境 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com