
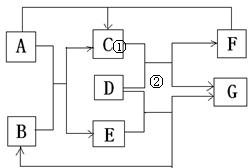
 如图AEG是单质,D由两种元素组成,相对分子质量为80,原子个数之比为1:1,两种元素质量之比为4:1;
如图AEG是单质,D由两种元素组成,相对分子质量为80,原子个数之比为1:1,两种元素质量之比为4:1; Cu+CO2;
Cu+CO2; Cu+H2O.
Cu+H2O. =16,该元素可判断为氧元素;另一元素的相对原子质量=80-16=64,该元素可推断为铜;则物质D为氧化铜;
=16,该元素可判断为氧元素;另一元素的相对原子质量=80-16=64,该元素可推断为铜;则物质D为氧化铜; 可计算出组成元素的相对原子量之比,结合物质的相对分子质量可计算组成元素的相对原子质量,利用相对原子质量判断组成元素.
可计算出组成元素的相对原子量之比,结合物质的相对分子质量可计算组成元素的相对原子质量,利用相对原子质量判断组成元素. 

科目:初中化学 来源: 题型:
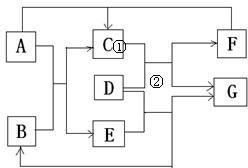 如图AEG是单质,D由两种元素组成,相对分子质量为80,原子个数之比为1:1,两种元素质量之比为4:1;
如图AEG是单质,D由两种元素组成,相对分子质量为80,原子个数之比为1:1,两种元素质量之比为4:1;查看答案和解析>>
科目:初中化学 来源:2010年江苏省无锡市中考化学模拟试卷(一)(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com