
【题目】凤凰盛产茶叶,茶叶中含锌、硒、茶氨酸(化学式为C7H14O3N2)等多种成分。结合下边信息图,下列说法正确的是( )
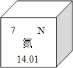
A. “锌、硒”指的是单质
B. 茶氨酸中含14个氢原子
C. 氮的相对原子质量为7,元素符号为N2
D. 茶氨酸的相对分子质量为174
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】黄铜是Zn以主要添加元素的铜合金。黄铜渣中约含Zn7%、ZnO31%、Cu50%、CuO5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水,不参与反应):
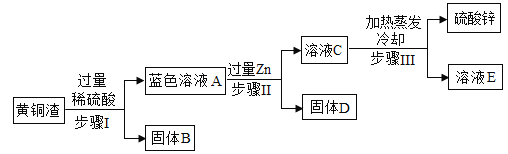
(1)溶液A中的金属阳离子有_____(填化学式)。
(2)步骤Ⅰ、Ⅱ、Ⅲ中包含的操作都要用到的玻璃仪器是_____。
(3)溶液A的质量_____(填“大于”、“小于”或“等于”)溶液C的质量。
(4)写出步骤Ⅱ中的化学方程式_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫酸在工业上有着重要的用途。
I.以黄铁矿(主要成分为FeS2)为原料生产硫酸的原理及工艺流程可简示如下:FeS2![]() SO2
SO2![]() H2SO4
H2SO4
(原理)
(工艺流程)
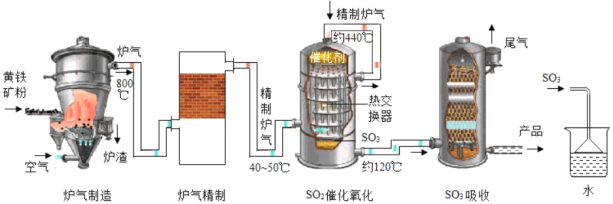
(1)黄铁矿是_____(填“纯净物”或“混合物”)工业生产过程中将矿石粉碎的目的是_____。
(2)在吸收装置中,液体由上而下形成喷雾状的目的是_____。
(3)在实验室模拟制硫酸时用如图装置吸收三氧化硫,除了达到与工业上相同的目的外,还可能考虑的因素是_____。
(4)工业上常用石灰乳来吸收尾气中的二氧化硫,请写出反应的化学方程式_____。(提示:生成物有一种是CaSO3)
II.黄铁矿锻烧后的另一种产物是铁的一种氧化物,其中铁氧质量比为7:3,则其化学式为_____。该物质可用来生产氯化铁晶体。氯化铁也是常用的净水剂之一,相比于明矾,其作为净水剂的优点是_____。
III.实验室中常用浓硫酸来配制稀硫酸。实验室用密度为1.84g/cm3、溶质质量分数为98%的浓硫酸来配制500g 20%,需要水_____g.溶解时,应_____,并用玻璃棒不断搅拌。该实验中还需用到的玻璃仪器有烧杯、量筒、_____。请写出稀硫酸的一种用途_____。
IV.某化工厂以黄铁矿为原料产生硫酸。如果该厂生产98%的浓硫酸100t,不考虑其他各生产阶段的物料损失,需要含FeS260%的矿石质量为多少吨?(写出计算过程)________________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】尿素[化学式CO(NH2)2]是一种重要的氮肥,在土壤中不残留有害物质,长期施用没有不良影响。硝铵(化学式NH4NO3)也是一种常用的氮肥。
(1)尿素分子中碳、氢、氧、氮的原子个数比为_____________
(2)尿素的含氮量_____________硝铵的含氮量;(填“>”“<”或“=”)
(3)计算多少质量的硝铵中含有30g氮元素__________(算结果精确到0.1)。
(4)计算多少质量的尿素与80g硝铵中的含氮量相当__________?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硝酸钾、氯化钠固体溶解度曲线如图1所示。20℃时,将硝酸钾、氯化钠固体各35g分别加入到100g水中,充分搅拌后现象如图2所示,加热到50℃时现象如图3所示(不考虑水分蒸发)。
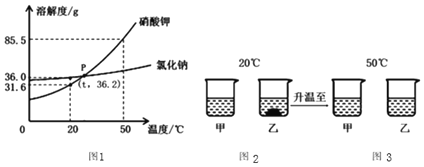
(1)图1中P点含义是______。
(2)烧杯甲中溶液的溶质是______(填化学式)。
(3)下列说法正确的是______(填标号)。
A 图2烧杯甲中的溶液是饱和溶液
B 图2烧杯乙中的溶液为饱和溶液
C 图3烧杯甲中溶液质量比烧杯乙中溶液质量大
(4)图3烧杯乙溶液中溶质的质量分数是______(结果保留一位小数),为使该溶液转化成饱和溶液,将溶液恒温蒸发50g水,是否可行______(填“是”或”否”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】图是 a、b、c三种物质的溶解度曲线:
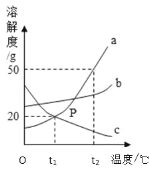
(1)t2℃时,a、b、c三种物质的溶解度由大到小的顺序是__________;
(2)a中混有少量的b,可采用_______(填“降温”或“蒸发”)结晶提纯a;
(3)t1℃时,用托盘天平称取10ga物质于一个烧杯中,再用量筒量取_____mL水加入烧杯中充分搅拌溶解得到a的饱和溶液。若量取水时仰视读数,则所得溶液为_________(填“饱和”或“不饱和”)溶液。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种环境友好的化工原料,工农业生产中用作漂白剂、种子消毒剂以及鱼类运输时的制氧剂等。过氧化钙与水反应方程式为:2CaO2+2H2O=2Ca(OH)2+O2↑。
(1)若用150g某过氧化钙工业样品可制得氧气32g,请计算该过氧化钙样品的纯度(样品中CaO2的质量分数)是多少?_____________
(2)往150g上述过氧化钙工业样品中逐渐加入水至过量,在图中画出产生氧气的曲线图。__________

(3)过氧化钠Na2O2与水发生类似上述的反应,请写出相应的化学方程式________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】图中A、B、C、D、E、F分别表示六种物质,B、C、D、F分别属于酸、碱、盐、氧化物四种类别中的一种,A是目前世界年产量最高的金属,B是可溶性银盐,D与E发生的反应属于中和反应(图中用“﹣”或“︵”表示两种物质之间能发生化学反应,用“→”或“![]() ”表示一种物质可转化为另一种物质,部分反应物和生成物及反应条件已略去,图中各部分反应需在溶液中进行)。下列说法不正确的是( )
”表示一种物质可转化为另一种物质,部分反应物和生成物及反应条件已略去,图中各部分反应需在溶液中进行)。下列说法不正确的是( )
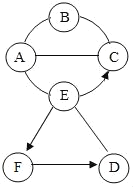
A. D可能是Ca(OH)2
B. E转化为F发生反应的化学方程式可以是2NaOH+H2SO4═Na2SO4+2H2O
C. 上述反应中涉及了四种基本反应类型
D. B与C发生反应的实验现象是有白色沉淀生成
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】同学们发现有一种“氮气灭火装置”能利用液氮(沸点为-196℃)产生的大量氮气来灭火。他们用氮气进行如右图所示实验,却发现蜡烛未熄灭。

(查阅资料)氮气密度略小于空气;压强不变时,气体温度越低,密度越大。
(1)结合氮气性质分析,右图蜡烛未熄灭的原因可能是_______。
实验1:探究氮气能否用来灭火(所用容器均为隔热材料,下同)
实验编号 | 1-1 | 1-2 | 1-3 |
实验内容 |
|
|
|
实验现象 | 蜡烛持续燃烧 | 蜡烛缓慢熄灭 | 蜡烛熄灭 |
(2)实验前有同学提出,由液氮汽化产生的氮气温度低,密度足够大,会向下流动隔 绝可燃物周围的氧气。依据实验1判断,这种假设_____(填“成立”或“不成立”)。
(3)有同学根据实验1提出新假设,氮气灭火可能与可燃物周围氮气的含量有关。可 能支持这一假设的实验现象是_______(填实验1中的实验编号)。
实验2:探究灭火与氮气含量是否有关
实验编号 | 2-1 | 2-2 | 2-3 |
实验内容 |
|
|
|
实验现象 | 蜡烛没有熄灭 | 蜡烛缓慢熄灭 |
(4)实验2中,蜡烛所在位置氮气含量最高的是_________(填实验编号)。
(5)推测实验2-3的现象是________。
(6)反思实验2,除氮气含量外,影响蜡烛燃烧的其它可能因素是________。
(7)结合上述实验,下列关于 “氮气灭火装置”使用的说法中,合理的是______(填字母序号)。
A. 从高处向低处喷洒使用
B. 可燃物火焰熄灭后,还需持续通气一段时间
C. 在有少量排气口的封闭空间中使用时,效果好于开放空间
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com