
【题目】生活中常见物质的性质制法等是化学研究的重要内容。完成下列试题。
(1)铁是生活中应用最广泛的金属,铁粉可以做某些食品的防腐剂,该铁粉的作用是_____。这种防腐剂失效后(主要成分为氧化铁),可用于实验室模拟工业炼铁,写出该反应的化学方程式_____,
(2)氢氧化钠稀溶液与稀盐酸反应过程中温度和pH的变化如图所示
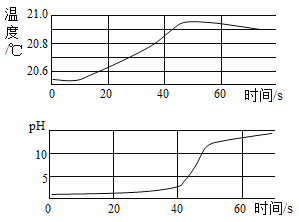
①该实验是将_____溶液中(填写滴加溶液的顺序)。
②该反应是_____反应(填“吸热”或“放热”)。
③40s时,溶液中溶质为_____
(3)除去NaCl溶液中CaCl2、MgCl2、Na2SO4杂质的操作有:a加过量的NaOH溶液; b加过量的Na2CO3溶液; c.加适量的盐酸; d过滤; e加过量的BaCl2溶液。
[提示:Mg(OH)2、BaSO4、BaCO3难溶于水]
①以上操作合理的先后顺序为_____(数字序号不能重复使用)。
②加入适量稀盐酸的作用是_____,
(4)向碳酸钠和氯化钠的固体混合物15.9g中加入100g稀盐酸,恰好完全反应后,得到111.5g溶液。则原混合物中碳酸钠的质量分数是多少?_____(结果精确到0.1%)
【答案】吸收氧气和水蒸气 Fe2O3+3CO![]() 2Fe+3CO2 氢氧化钠稀溶液滴加到稀盐酸 放热 HCl和NaCl aebdc, 除去多余的氢氧化钠和碳酸钠,调整溶液的pH为7 66.7%
2Fe+3CO2 氢氧化钠稀溶液滴加到稀盐酸 放热 HCl和NaCl aebdc, 除去多余的氢氧化钠和碳酸钠,调整溶液的pH为7 66.7%
【解析】
铁生锈是铁与氧气和水反应,镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀。
(1)铁生锈是铁与氧气和水反应,铁粉可以做某些食品的防腐剂,该铁粉的作用是吸收氧气和水蒸气。这种防腐剂失效后(主要成分为氧化铁),可用于实验室模拟工业炼铁,该反应的化学方程式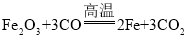 。
。
(2)①由溶液的pH由小于7逐渐增大到等于7、大于7,说明了该实验是将氢氧化钠稀溶液滴加到稀盐酸 溶液中。
②该反应过程中溶液温度升高,说明了该反应是放热反应。
③由图示可知,40s时,溶液中的稀盐酸未完全反应,溶液中溶质为HCl和NaCl。
(3)镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子调整溶液的pH,所以合理的先后顺序为aebdc。
(4)根据质量守恒定律可知,生成的二氧化碳的质量为![]()
设混合物中碳酸钠的质量为x
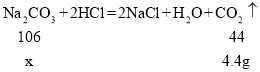
![]()
![]()
原混合物中碳酸钠的质量分数是为![]()
故原混合物中碳酸钠的质量分数是66.7%。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:初中化学 来源: 题型:
【题目】一氧化二氮和一氧化碳是环境污染性气体,可在催化剂表面转化为无害气体。该反应前后分子种类变化的微观示意图如图。下列说法不正确的是( )
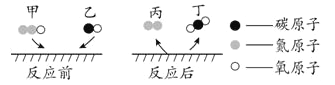
A. 甲的化学式为N2O
B. 乙的相对分子质量为28
C. 反应前后分子总数不变
D. 生成的丙与丁的质量比为1:1
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是a、b两种固体物质的溶解度曲线,试回答:
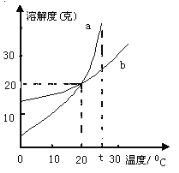
(1)t℃时,两物质的溶解度的大小关系:a_____b(填“大于”、“等于”或“小于”)
(2)当a中含有少量b时,可以用_____法提纯a;
(3)a、b都属于_____物质;(填“难溶”、“微溶”、“可溶”、“易溶”)
(4)在20℃时a、b的溶解度相等,此时a、b饱和溶液中溶质质量分数是_____。(计算结果保留0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】分别向50g FeSO4和CuSO4溶液中,加入一定质量Mg 粉恰好完全反应。随Mg粉消耗,Mg粉与溶液中FeSO4、CuSO4的质量变化见图。请读取图象信息并结合金属活动性顺序分析,下面说法不合理的是( )
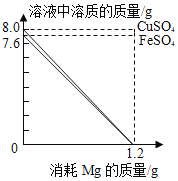
A.反应前,两溶液中溶剂水的质量相等
B.反应前,两溶液中溶质质量分数:FeSO4<CuSO4
C.反应后,两溶液底部析出金属的质量:Fe<Cu
D.反应后,若FeSO4和CuSO4对应新溶液的溶质质量分数分别为A、B,则A<B
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组向一定量AgNO3、Cu(NO3)2、Al(NO3)3混合溶液中加入一定量的锌粉,充分反应后过滤,滤液呈蓝色。
(1)向滤渣上滴加稀盐酸,_____(填“有”或“没有”)气泡产生。
(2)滤液中一定含有的溶质是_____。
(3)写出一定发生的化学反应方程式_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一包固体粉末可能含有NaNO3、CaCO3、NaOH、FeCl3、NaCl和Ba(NO3)2中的一种或几种,为确定其组成,现做如下实验:取少量固体加足量的水溶解,过滤得沉淀I和无色溶液I,后续实验及现象如图:
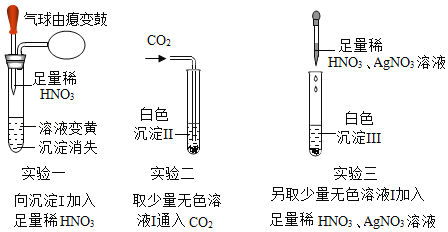
(1)写出实验一中,使溶液变黄的反应化学方程式___。
(2)白色沉淀Ⅱ是___(填化学式)。
(3)通过上述实验,固体粉末中不能确认是否存在的物质是___。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(6分)我市盛产石灰石,主要成分是CaC03。某同学为了测定石灰石中碳酸钙的质量分数进行了如下实验。取一定量的石灰石样品研碎和100g溶质质量分数为10%的稀盐酸放入烧杯中。在化学反应过程中对烧杯及其中的剩余物进行了五次称量,记录数据如下表:(假设反应匀速进行;杂质不溶于水,也不与稀盐酸反应,烧杯的质量为25g。)
反应时间/s | 20 | 40 | 60 | 80 | 100 |
烧杯和药品质量/g | 137.8 | 135.6 | m | 134.5 | 134.5 |
请计算:
(1)表中的“m”为_ g;
(2)该石灰石样品中碳酸钙的质量分数。(计算结果精确至0.1 % )
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知A、B是两种常见的单质,甲、乙是两种常见的化合物。常温下A为黑色固体,其余均为气体。在一定条件下它们之间相互转化的关系如右图所示,按要求完成下列化学反应方程式:
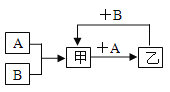
(1)A+B 反应的化学方程式:____________________。
(2)甲+A反应的化学方程式:___________________。
(3)乙+B反应的化学方程式:___________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
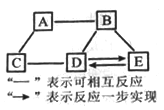
【题目】A~E均为初中化学常见的物质,它们之间的关系如图所示(部分物质已经略去)。已知A是目前世界上年产量最高的金属;B是胃酸的主要成分;C中金属元素的质量分数为40%, 其水溶液呈蓝色,常用来配制农药波尔多液;D属于碱;E属于盐。则C的化学式为__________;A与B反应的化学方程式为__________;E转化为D的化学方程式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com