
查阅图的溶解度曲线,回答下列问题:
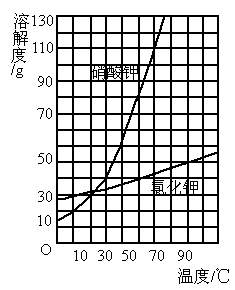
(1)50
℃时,硝酸钾的溶解度_______(大于、等于、小于)氯化铵的溶解度;(2)60
℃时,一定质量的硝酸钠和硝酸钾分别溶解在100g水中达到饱和,冷却到20℃时,析出晶体最多的是_________;(3)70
℃时,硝酸钾饱和溶液的质量分数是________(4)
为了从混有少量氯化钠的硝酸钾中提取纯净的硝酸钾,可以采用________的方法. 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:

| 实验操作 | 实验现象 | 实验结论 |
| |
| 温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
 (2013?红桥区二模)某实验室欲配制一定溶质质量分数的KNO3溶液,现实验室只有含少量NaCl的KNO3固体药品.
(2013?红桥区二模)某实验室欲配制一定溶质质量分数的KNO3溶液,现实验室只有含少量NaCl的KNO3固体药品.查看答案和解析>>
科目:初中化学 来源: 题型:
 (2007?湘潭)在我国某地区有一种“冬天捞碱,夏天晒盐”的说法.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中含有少量的NaCl.
(2007?湘潭)在我国某地区有一种“冬天捞碱,夏天晒盐”的说法.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中含有少量的NaCl.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com