
| A. | NaCl CuSO4 NaNO3 | B. | NaCl K2SO4 NaOH | ||
| C. | HCl NaOH CaCl2 | D. | K2CO3 KNO3 BaCl2 |
科目:初中化学 来源: 题型:选择题
| A. | 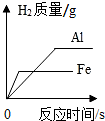 等质量的铁片、铝片分别与足量且质量分数相同的稀硫酸反应 | |
| B. |  向H2SO4和MgSO4的混合溶液中滴加NaOH溶液 | |
| C. | 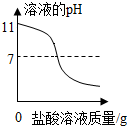 向pH=11的NaOH溶液中不断加稀盐酸 | |
| D. | 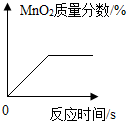 加热KClO3和MnO2的混合物 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 202g | B. | 256g | C. | 252g | D. | 不能确定 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 利用太阳能分解水 | B. | 由焦炭和水蒸气反应生成氢气 | ||
| C. | 由热电站提供电力电解水 | D. | 使赤热的铁和水反应生成氢气 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
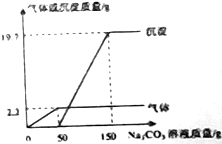 在实验课上,同学们用Ba(OH)2和稀盐酸做中和反应的实验探究,小亮取反应后的溶液105.9g,滴入碳酸钠溶液,先后有气体和白色沉淀生成.加入碳酸溶液与生成沉淀的气体的质量关系如图所示.
在实验课上,同学们用Ba(OH)2和稀盐酸做中和反应的实验探究,小亮取反应后的溶液105.9g,滴入碳酸钠溶液,先后有气体和白色沉淀生成.加入碳酸溶液与生成沉淀的气体的质量关系如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
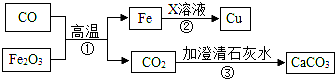
| A. | 反应①中CO发生氧化反应 | |
| B. | 反应②的化学方程式是:Fe+Cu(OH)2=Cu+Fe(OH)2 | |
| C. | X溶液可能是硫酸铜溶液 | |
| D. | 反应③可以检验二氧化碳气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液. | 产生白色沉淀 | 反应的化学方程式: Na2CO3+CaCl2═CaCO3↓+2NaCl |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com