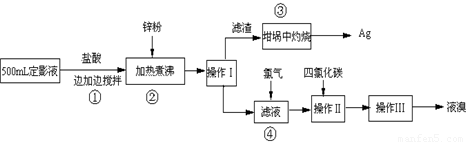
解:(1)由操作Ⅰ得到滤液和滤渣,通过过滤可以把不溶性固体和液体分离开,移取坩埚或蒸发皿等温度很高的仪器的方法是使用坩埚钳,否则会烫伤手;
(2)由Ag
2S在氧气中灼烧,除了有银生成外,还有一种气体生成,可知反应物是Ag
2S和O
2,生成物有银,根据质量守恒定律可知生成物中气体是由硫元素和氧元素组成,所以是二氧化硫,用观察法配平即可,反应条件是加热写在等号的上边,由于二氧化硫是有毒气体,排放到空气中污染空气,所以要用氢氧化钠吸收;
(3)浓溶液变为稀溶液加入的是水,溶质不变,设需要30%的浓盐酸(密度为1.1克/毫升)的体积为X则:330毫升×1.0克/毫升×20%═X×1.1克/毫升×30%,解得X=200毫升;需要水:330毫升×1.0克/毫升-200毫升×1.1克/毫升=110克,所以水的体积为:
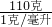
=110毫升;用量筒量取盐酸,量取时用到胶头滴管,将量取的液体倒入烧杯中,用玻璃棒搅拌,所以用到的仪器有:量筒、胶头滴管、烧杯、玻璃棒;
(4)一种单质和化合物反应生成单质和化合物,属于置换反应;在NaBr中钠元素显+1价,根据在化合物中正负化合价代数和为零可知溴显-1价;Br
2属于单质,单质化合价为零;
(5)化学式的读法是从右向左读,将右下角数字读出来,所以四氯化碳的读法是CCl
4;由溴难溶于水,易溶于有机溶剂,四氯化碳属于有机溶剂,可知四氯化碳是为了溶解溴.
故答案为:(1)过滤;坩埚钳;(2)Ag
2S+O
2
2Ag+SO
2;氢氧化钠;(3)200;110;烧杯;玻璃棒;(4)置换反应;-1;0;(5)CCl
4;溶解溴.
分析:(1)根据不溶性固体和液体分离的方法考虑;根据移取坩埚或蒸发皿等温度很高的仪器的方法考虑;(2)根据方程式的写法和二氧化硫的毒性考虑;(3)根据浓溶液变为稀溶液加入的是水,溶质不变列等式进行计算,根据实验步骤考虑需要的仪器;(4)根据置换反应的特点和化合价的计算方法考虑;(5)根据化学式的读法和书写方法写出化学式;根据溴的溶解性考虑.
点评:解答本题关键是要知道过滤分离的物质特点,知道方程式的写法,了解溶液稀释的方法和用到的仪器,熟悉置换反应的特点,知道化合价的计算方法.


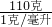 =110毫升;用量筒量取盐酸,量取时用到胶头滴管,将量取的液体倒入烧杯中,用玻璃棒搅拌,所以用到的仪器有:量筒、胶头滴管、烧杯、玻璃棒;
=110毫升;用量筒量取盐酸,量取时用到胶头滴管,将量取的液体倒入烧杯中,用玻璃棒搅拌,所以用到的仪器有:量筒、胶头滴管、烧杯、玻璃棒; 2Ag+SO2;氢氧化钠;(3)200;110;烧杯;玻璃棒;(4)置换反应;-1;0;(5)CCl4;溶解溴.
2Ag+SO2;氢氧化钠;(3)200;110;烧杯;玻璃棒;(4)置换反应;-1;0;(5)CCl4;溶解溴.

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案