
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
| 溶液 | 现象 | 溶液 | 现象 | 溶液 | 现象 |
| ①稀硫酸 | 一 | ③稀硫酸(加入少量Na2SO4固体) | 一 | ⑤盐酸 (1:4) |
+ |
| ②稀硫酸 (加热) |
+ | ④稀硫酸(加入少量NaCl固体) | + | ⑥盐酸 (37%) |
++ |
查看答案和解析>>
科目:初中化学 来源: 题型:
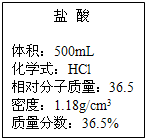 实验室有一瓶浓盐酸,瓶上标签如图所示,请你根据标签上提供的数据解答下列问题.
实验室有一瓶浓盐酸,瓶上标签如图所示,请你根据标签上提供的数据解答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:
| 溶液 | 现象 | 溶液 | 现象 | 溶液 | 现象 |
| ①稀硫酸 | 一 | ③稀硫酸(加入少量NaSO4固体) | 一 | ⑤盐酸(1:4) | + |
| ②稀硫酸(加热) | + | ④稀硫酸(加入少量NaCl固体) | + | ⑥盐酸(37%) | ++ |
查看答案和解析>>
科目:初中化学 来源: 题型:
 实验室有一瓶浓盐酸,瓶上标签如图所示,请你根据标签上提供的数据解答下列问题.
实验室有一瓶浓盐酸,瓶上标签如图所示,请你根据标签上提供的数据解答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 某学习小组的三位同学为测定镀锌铁皮的锌镀层的厚度,提出了各自的设计方案.(忽略锌镀层的氧化)
某学习小组的三位同学为测定镀锌铁皮的锌镀层的厚度,提出了各自的设计方案.(忽略锌镀层的氧化)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com