
(8分)“白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一。镀锌层犹如铁皮的保护层,这层膜的厚度是判断镀层质量的重要指标。某研究性学习小组为了测定镀锌铁皮镀锌层的厚度,查阅了资料,并设计了下面的实验方案。
【查阅资料】
A.锌既能与酸反应,也能与碱溶液反应。与碱溶液反应的化学方程式为:
Zn+2NaOH+2H2O=Na2[Zn(OH)4]+H2↑
B. ZnCl2、FeCl2都能与NaOH溶液反应,生成难溶于水Zn(OH)2和Fe(OH)2。
C. Zn(OH)2既可以溶于酸也可以溶于碱,Fe(OH)2则只能溶于酸。
【问题讨论】在铁皮表面镀锌是为了 。(填字母)
a.锌没有铁活泼,镀在铁的表面可防止生锈
b.锌比铁活泼,并且在空气中容易形成致密的氧化膜,防止生锈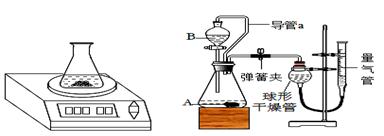
图1 图2
【设计实验】
(1)甲同学设计的方案是将镀锌铁皮浸泡在盐酸中,先用盐酸将镀锌铁皮表面的锌反应掉,通过测量因产生气体而形成差量计算出锌的质量,然后再计算得到锌层的厚度(如图1)。但是乙同学回顾起上课时老师演示的“用足量盐酸除铁锈”的实验现象,马上对甲同学的方案的可行性提出了异议,乙同学的理由是 。该实验中锌镀层已完全反应的标志是 。
(2)乙同学拟通过称量镀锌铁皮和氧化铁的质量,计算锌皮的厚度。方案如下图所示:
步骤②中加入足量氢氧化钠溶液的目的是 。
(3)丙同学拟通过测量镀锌铁皮与某溶液反应产生气体的体积来计算锌层的厚度,装置如
图2所示。
Ⅰ.为了尽可能减少误差,仪器A中盛放的是镀锌铁皮,仪器B中最好盛放 。
A.氢氧化钠溶液 B.浓硫酸 C.浓盐酸 D.稀硫酸
Ⅱ.检查量气装置气密性:连接好装置,关闭弹簧夹,从量气管注水,若观察到 ,说明该量气装置气密性良好。
Ⅲ.检查气密性后,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录量气管中的液面位置;②待A中不再有气体产生并恢复至室温;③由B向A中滴加足量某溶液;④上下移动量气管,使干燥管和量气管中液面相平。上述操作的顺序是 (填序号)。
Ⅳ.若分液漏斗上方不连接导管a,则测出气体体积会 (选填“偏小”、“偏大”或“没有影响”)。
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:初中化学 来源: 题型:填空题
2011年9月29日21时“天宫一号”目标飞行器在酒泉卫星发射中心发射(如下图所示),它是中国首个空间实验室,将分别与神舟八号、神舟九号、神舟十号飞船对接,从而建立第一个中国空间实验室.其结构主要包括外部壳体、实验舱、资源舱、燃料燃烧系统、对接机构和太阳能电板等,制作材料有铝、耐高温的石墨瓦、不锈钢、钛、镍和铜等等.试回答下列问题:
(1)不锈钢属于 (填“纯净物”、“混合物”).
(2)单质铜的金属活动性 单质铝的金属活动性(填“大于”、“小于”、“等于”);请设计简单实验验证(只要写出方法或用化学方程式表示) .
(3)钛是一种密度小、熔点高、耐腐蚀的优良金属,有“未来金属”的美誉,工业上冶炼钛的原理是TiCl4+4Na Ti+4NaCl;该反应属于 (填基本反应类型),反应物TiCl4中钛元素的化合价为 ,氯化钠是由 (填“分子”、“原子”或“离子”)构成的.
Ti+4NaCl;该反应属于 (填基本反应类型),反应物TiCl4中钛元素的化合价为 ,氯化钠是由 (填“分子”、“原子”或“离子”)构成的.
查看答案和解析>>
科目:初中化学 来源: 题型:问答题
(7分)人类的生产、生活离不开金属。
(1)地壳中含量最高的金属元素是 。
(2)用铜制电线主要是利用铜具有良好的延展性和 性。
(3)将生锈的铁片放入足量稀硫酸中,发生置换反应的化学方程式为 。
(4)在硫酸铜和硫酸亚铁的混合溶液中加入一定量的锌粉,充分反应后过滤,向滤渣中滴加稀硫酸,无气泡产生。则滤渣中的金属是 ,滤液中溶质的组成是 (写出所有可能)。
(5)将质量相等的锌粉和铁粉,分别放入两个烧杯中,再分别倒入质量相等、溶质的质
量分数相同的稀盐酸,充分反应,生成氢气的质量(m)随反应时间(t)变化的曲
线如图所示。下列说法正确的是 (填字母序号)。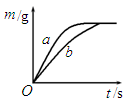
| A.消耗两种金属的质量相等 |
| B.两烧杯中金属都没有剩余 |
| C.两烧杯中稀盐酸都没有剩余 |
| D.曲线a表示锌和稀盐酸的反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
钢铁产业是我国的支柱产业之一,选择优质炼铁原料十分重要。甲、乙两组同学对某钢铁厂所购进的赤铁矿粉中主要成分Fe2O3的含量进行测定。(假设每步反应均能完全进行,赤铁矿粉中杂质性质稳定,既不溶于水也不参与反应,浓硫酸可吸收水蒸气)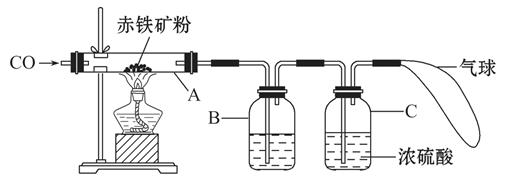
(1)甲组同学称取一定质量的赤铁矿粉,采用如图的装置进行实验。
①装置A中发生反应的化学方程式是 。
②为充分吸收反应生成的CO2,装置B中应盛放的试剂是 浓溶液。
③可以通过下面不同的方法计算赤铁矿粉中Fe2O3的含量:
【方法一】称量反应前后A装置的总质量,计算出Fe2O3的含量;
【方法二】称量 得出反应生成的CO2的质量,计算出Fe2O3的含量。
(2)乙组同学称取等质量的赤铁矿粉放入烧杯中,向烧杯中加入过量的稀硫酸充分反应(氧化铁与稀硫酸反应生成硫酸铁和水), (填一个操作名称)后立即称量。根据称量的数据计算出Fe2O3的含量。
(3)甲、乙两组同学通过相互比较后对各自的实验方案进行评价。
| 方案 | 优 点 |
| 甲组 | |
| 乙组 | |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
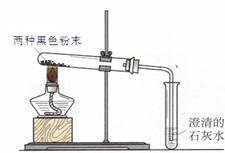
同学们在帮助老师整理实验室时,从1、2号橱窗中发现了两瓶失去标签的黑色粉末药品,并确定了这两瓶黑色粉末是木炭粉、铁粉、氧化铜、高锰酸钾中的两种。他们继续进行了分析、试验和反思:
【查阅资料】 CuO、Fe2O3等金属氧化物与酸反应,生成盐和水
(1)分析:小燕同学认为一定不是高锰酸钾,原因是__________________________________;
(2)实验一:
| 实验操作 | | |
| ①取一种黑色粉末少许,加入到稀硫酸中 | 黑色粉末溶解,溶液颜色变_________ | 此粉末是氧化铜 |
| ②取另一种黑色粉末少许,加入到稀硫酸中 | 黑色粉末不溶解,没看到气体产生 | 此粉末一定不是铁粉 |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
在生活中经常曝出某品牌金饰品掺假的事件,引起学生的好奇,某化学兴趣小组在老师的帮助下,对几种常见金属饰品所含的金属进行了相关的探究活动.
【提出问题】(1)怎样鉴别真假黄金?(2)怎样确定钯的金属活动性?
【查阅资料】
(1)假黄金通常是黄铜(Cu﹣Zu合金) (2)钯(Pd)呈银白色,有金属光泽,可用作饰品
【实验药品】钯、铂(Pt)、稀盐酸、硝酸银溶液和氯化钯(PdCl2)溶液
【实验探究】
(1)鉴别黄金样品的真假:取黄金样品于试管中,滴加稀盐酸后,观察黄金样品表面有气泡产生,该气体是 (填名称),说明此样品为 (填“真”或“假”)黄金.
(2)探究钯的金属活动性:依据生活经验,同学们猜测钯的活动性可能与银和铂相近,于是他们利用上述药品进行如下实验:
| 实验步骤 | 实验现象 | 实验结论 |
| 把钯浸入硝酸银溶液中 | 无明显现象 | 钯的活动性比银 |
| 把铂浸入氯化钯溶液中 | | 钯的活动性比铂强 |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
某同学利用以下药品:长、宽和厚度均相同的锌片、铁片与铜片、稀硫酸、硫酸亚铁溶液、硫酸铜溶液、硫酸锌溶液、锌粉,进行锌、铁、铜的金属活动性顺序探究等实验。
(1)实验前,用砂纸打磨金属片的目的是 ;
(2)根据实验目的,该同学设计了实验I、Ⅱ两种合理的方案,如图1所示: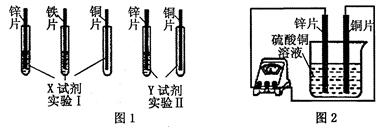
若X、Y是两种不同的试剂,则X、Y中溶质的化学式依次为 、 ;
(3)实验后,该同学将硫酸亚铁溶液和硫酸铜溶液混合在一起,发现溶液呈现青色。他又用混合液分别进行以下实验:
A.向混合液中加入过量锌粉,搅拌,溶液颜色的变化为:青色变浅至 色,最终变为无色;
B.向混合液中插入锌片,待其浸没部分表面完全变色后,溶液仍为青色,取下锌片表面附着的粉末,经检验其组成为铁和铜。和老师一起分析粉末中存在铁的原因:
①反应生成了铁,写出该反应的化学方程式: ;
②铜和锌构成原电池,电子转移过程中亚铁离子得到电子变成铁单质;
(4)如图2所示,该同学用导线将锌片和铜片连接起来,接入电流表,然后把它们一起插入硫酸铜溶液中,该实验的现象为:
①电流表指针是否发生偏转 (选填“是”或“否”);
②铜片表面变粗。
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
铬(Cr)是一种重要的金属材料,它具有良好的金属光泽和抗腐蚀性,常用来镀在其他金属的表面上,铜、铬、锰、镍组成合金可以制成各种性能的不锈钢。某校化学研究小组对Cr(铬)、Al、Cu的金属的活动性顺序进行探究,过程如下:
(1)[作出假设]对三种金属的活动性顺序提出三种可能的假设是:
①Cr>Al>Cu②Al>Cr>Cu③Cr>Cu>Al
[设计实验]同温下,取大小相同的这三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,观察现象,记录以下:
| 金属 | Cr | Al | Cu |
| 与盐酸反应现 | 气泡产生缓慢,金属逐渐溶解 | 气泡产生激烈,金属迅速溶解 | 无气泡产生,金属无变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
(3分) 如下图是某同学设计的趣味实验装置,气密性良好。
写出甲仪器的名称_____________________。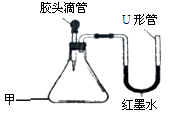
若胶头滴管中是NaOH溶液,要使U形管出现左高右低,则甲中的气体物质为____________。(写化学式)
若胶头滴管中是水,要使U形管出现左低右高,而后恢复相平的现象,则甲中的固体物质可能是_______________。(写化学式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com