

分析 (1)根据图中元素周期表可以获得的信息:左上角的数字表示原子序数;字母表示该元素的元素符号;中间的汉字表示元素名称;汉字下面的数字表示相对原子质量,进行分析解答即可.
(2)根据原子中核电荷数=核内质子数,进行分析解答.
(3)根据微粒符号的写法来分析.
解答 解:(1)根据钙元素周期表中的一格中获取的信息,左上角的数字为20,表示原子序数为20;根据原子序数=核电荷数=质子数,则该元素的原子质子数为20.故填:20;
(2)原子中核电荷数=核内质子数,18=2+8+X,X=8.故填:8;
(3)C微粒核内有17个质子,核外有18个电子,是氯离子,故填:Cl-.
点评 本题难度不大,灵活运用元素周期表中元素的信息、明确粒子中核内质子数和核外电子数之间的关系、决定元素化学性质的因素等是即可正确决定本题.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
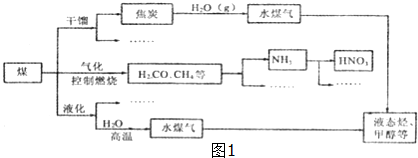
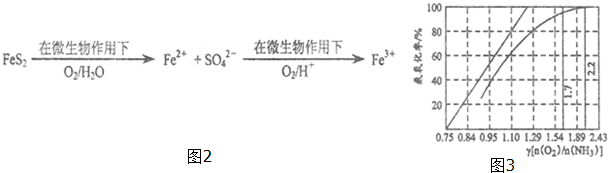
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 物质 | A | B | C | D |
| 反应前质量/g | 2 | 26.5 | 2 | 10 |
| 反应后质量/g | 16.9 | 2 | 2 | 待测 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 构成“高密度液态水”的分子与普通水的分子不同 | |
| B. | “高密度液态水”分子不再运动 | |
| C. | “高密度液态水”中氢、氧两种元素的质量比为1:8 | |
| D. | “高密度液态水”分子间的间隔比普通水大 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com