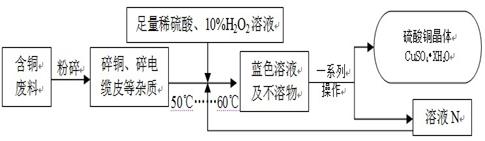
试题分析:I 、(1)在方案1中,由于加热可增加反应物分子的运动速率,搅拌会使反应物混合更均匀,故可增加反应物相互接触的机会,因此加热搅拌的作用是加快反应速率;根据题意分析,形成蓝色溶液的现象的反应是氧化铜与硫酸反应,生成硫酸铜和水,故化学反应的方程式是CuO+H
2SO
4=CuSO
4+H
2O。
(2)根据资料可知,“对过氧化氢的水溶液加热、光照或加催化剂(如MnO
2)都会促进其分解”,故在方案2中,加入H
2O
2后要求温度控制在50℃到60℃,是为了防止其受热分解。
(3)从环保的角度分析可知,由于甲方案的第一步是灼烧,会产生一些污染空气的气体,粉尘,烟雾等,即会污染空气,由此可知方案2更合理。
(4)根据图示,结合已有的部分操作步骤分析,因为过滤后的滤液要进行冷却结晶,故需先进行蒸发浓缩A,这样才好对其冷却结晶;又由于最终要得到的是硫酸铜晶体,故结晶后还需过滤D、洗涤和干燥等。
(5)根据图示,溶液M、N都是析出硫酸铜晶体后的溶液,即均不能继续溶解硫酸铜,故均属于硫酸铜的饱和溶液;向硫酸铜的饱和溶液中加入无水CuSO
4,由于硫酸铜粉末能与水化合,故饱和溶液中的溶剂会减少了,则会有相应的溶质的析出。
(6)根据资料可知,CuSO
4·XH
2O易溶于水难溶于酒精,故可用少量95%的酒精洗涤硫酸铜晶体,这样可减少硫酸铜晶体因溶于水而有部分损失。故选B
II、(7)根据资料,CuSO
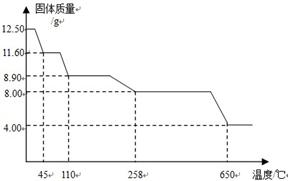
4·XH
2O加热时会逐步失去结晶水,最终生成CuSO
4,结合题意,“258℃时,固体完全变成白色粉末”,说明此时硫酸铜晶体(CuSO
4·xH
2O)已完全分解生成硫酸铜和水,则该反应可表示CuSO
4?xH
2O
△CuSO
4+xH
2O;再结合图中数据可知,258℃时,剩余固体质量为8g,则根据胆矾晶体受热分解的化学方程式和胆矾与硫酸铜的质量,以及它们之间的固定质量比,就可计算出胆矾晶体中x的值。
CuSO
4?xH
2O
△CuSO
4+xH
2O
160+18x 160
12.50g 8g
(160+18x):160=12.50g:8g
解得,x=5
(8)根据题意,加热过程中,硫酸铜晶体会分步失去结晶水,故可将反应表示为CuSO
4?5H
2O
△CuSO
4?mH
2O+(5-m)H
2O;结合图中数据可知,45℃时,剩余固体质量为11.6g,则根据反应的方程式和两固体的质量、以及质量比,可计算出其中m的值。
CuSO
4?5H
2O
△CuSO
4?mH
2O+(5-m)H
2O
250 160+18m
12.5g 11.6g
250:(160+18m)= 12.5g:11.6g
解得,m=4,
即此时所得晶体为CuSO
4?4H
2O;
同理,根据图中数据110℃时,剩余固体质量为8.9g,同样可计算出所得晶体中所含结晶水的量,可设所得晶体为CuSO
4?nH
2O,则有
CuSO
4?5H
2O
△CuSO
4?nH
2O+(5-n)H
2O
250 160+18n
12.5g 8.9g
250:(160+18n)= 12.5g:8.9g
解得,n=1,
即此时所得晶体为CuSO
4?H
2O,
故45℃到110℃时反应的方程式为CuSO
4?4H
2O
△CuSO
4?H
2O+3H
2O。
(9) 根据题意,580℃以上时,硫酸铜粉末就会发生分解,生成黑色金属氧化物、二氧化硫及氧气,根据质量守恒定律中的元素守恒可知,该金属氧化物应是氧化铜,故此反应的化学方程式为 2CuSO
4
2CuO+2SO
2↑+O
2↑。
点评:本题难度较大,考查了多方面的知识,并侧重考查了学生运用所学化学知识综合分析和解决实际问题的能力,关于根据化学反应方程式的计算,解题的关键是要抓住“加热过程中,硫酸铜晶体会分步失去结晶水”这句话,然后根据相关的化学反应方程式,并依据已知量对未知的应求量进行求解计算即可。


 CuSO4·H2O+3H2O↑
CuSO4·H2O+3H2O↑ 2CuO+2SO2↑+O2↑
2CuO+2SO2↑+O2↑ 2CuO+2SO2↑+O2↑。
2CuO+2SO2↑+O2↑。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
 Na2CO3↑+CO2 ↑+H2O ;
Na2CO3↑+CO2 ↑+H2O ;