
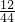 ×100%=1.2g,3.6g水中氢元素的质量=3.6g×
×100%=1.2g,3.6g水中氢元素的质量=3.6g× ×100%=0.4g.1.2g+0.4g=1.6g与该物质的质量不相等,故一定含氧元素.其中氧元素的质量为3.2g-(1.2g+0.4g)=1.6g,所以碳、氢、氧元素的质量比=1.2g:0.4g:1.6g=3:1:4.
×100%=0.4g.1.2g+0.4g=1.6g与该物质的质量不相等,故一定含氧元素.其中氧元素的质量为3.2g-(1.2g+0.4g)=1.6g,所以碳、氢、氧元素的质量比=1.2g:0.4g:1.6g=3:1:4.

 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 设计这一步骤的目的 |
| 1.用煮沸过的蒸馏水配制氢氧化钠溶液. | |
| 2.在氢氧化钠溶液中滴入酚酞,并在上方滴一些植物油. |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 选项 | A | B | C | D |
| 物质 | 橘子 | 泡菜 | 葡萄 | 玉米粥 |
| pH | 2.9~3.5 | 3.0~4.0 | 3.5~4.5 | 6.8-8.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 设计这一步骤的目的 |
| 1.用煮沸过的蒸馏水配制氢氧化钠溶液. | |
| 2.在氢氧化钠溶液中滴入酚酞,并在上方滴一些植物油. |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com