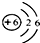�⣺��1������̼��������������������ģ����ٺ�̼���ʵ��ͷţ���Ҫ��ָ����CO
2���ŷ�����
��2��A��̼Ԫ�����ڷǽ���Ԫ�أ���A��ȷ��
B��̼ԭ�Ӻ���������Ϊ6����B��ȷ
C��̼ԭ�Ӻ���������Ϊ6��֪̼Ԫ�ص�ԭ�ӽṹʾ��ͼΪ

����C����
D����ͼ1��֪̼�����ԭ������Ϊ12.01����D��ȷ��
��3������������Һ�Ͷ�����̼��Ӧ����̼���ƺ�ˮ��ʹƿ��ѹǿ��С�����Կɹ۲쵽�����ʹ�ѧ����ʽ2NaOH+CO
2=Na
2CO
3+H
2O��
��4������1��̼��������270�����Ҿ��ֽܷ�Ϊ̼���ơ�ˮ�Ͷ�����̼���ڸ��¶���ˮ����̬�ģ����Է�Ӧ�Ļ�ѧ����ʽΪ2NaHCO
3
Na
2CO
3+H
2O��+CO
2����
��2��ʹ������ǯ�Ѽ��Ⱥ���������������C�н�����ȴ����ֹ��ȴ���������տ����е�ˮ�֣���Ӱ�����ij����Ľ����
��3������Ʒ��̼�����Ƶ�����Ϊx
2NaHCO
3
Na
2CO
3+H
2O��+CO
2�� ������������
168 106 168-106=62
x m
1-m
2
x=

��Ʒ��̼�����Ƶ���������=

��100%=

��100%��
��4��������Ʒ��̼�����Ƶ���������Ϊ90%��������ٵ�����0.6g������Ʒ��̼�����Ƶ����������Ĵ���ʽ����֪��

��100%=90%
��m
1-a��=

=1.8g
���������Ʒ������Ϊ1.8g��
�ʴ�Ϊ����1��CO
2����2��C����3������������Һ�Ͷ�����̼��Ӧ����̼���ƺ�ˮ��ʹƿ��ѹǿ��С��2NaOH+CO
2=Na
2CO
3+H
2O����4������1��2NaHCO
3
Na
2CO
3+H
2O��+CO
2������2������ǯ��C����3��

��100%����4��1.8g��
��������1�����ݡ���̼��������������������ģ����ٺ�̼���ʵ��ͷţ���Ҫ��ָ����CO
2���ŷ������н��
��2������Ԫ�����ڱ������ṩ����Ϣ���н��
��3����������������Һ�Ͷ�����̼��Ӧ����̼���ƺ�ˮʹƿ��ѹǿ��С���н��
��4������1��������Ϣ��̼��������270�����Ҿ��ֽܷ�Ϊ̼���ơ�ˮ�Ͷ�����̼��д��̼���������ȷֽ�Ļ�ѧ����ʽ��
��2��Ϊ��ֹ���Ⱥ���������ȴ���������տ�����ˮ��Ӱ��ⶨ�����Ӧ���ڸ������н�����ȴ��
��3�����������غ㶨�ɣ��ɼ���ǰ��ʣ�����ʵ����������÷ֽⷴӦ��������̼��ˮ��������������ٵ��������ɹ�����ٵ��������ݻ�ѧ����ʽ�������Ʒ��̼����������������һ��������Ʒ��̼�����Ƶ�����������
��4�����ݼ�����Ʒ��̼�����Ƶ���������Ϊ90%��������ٵ�����0.6g������Ʒ��̼�����Ƶ����������Ĵ���ʽ����������������Ʒ��������
���������ʱ��Ҫע��������ڼ���ʱ������С�����ڷֽ����ɶ�����̼��ˮ��ԭ����ˣ�����ʱ���ܰѴ����������ų�������̼���������㣮



 ����C����
����C���� Na2CO3+H2O��+CO2����
Na2CO3+H2O��+CO2���� Na2CO3+H2O��+CO2�� ������������
Na2CO3+H2O��+CO2�� ������������

 ��100%=
��100%= ��100%��
��100%�� ��100%=90%
��100%=90% =1.8g
=1.8g Na2CO3+H2O��+CO2������2������ǯ��C����3��
Na2CO3+H2O��+CO2������2������ǯ��C����3�� ��100%����4��1.8g��
��100%����4��1.8g��

 �����ߴ���ϵ�д�
�����ߴ���ϵ�д�
 ̼���γɻ�������������Ԫ�أ���̼��������ѧ��ѧ�о�����Ҫ���ݣ�
̼���γɻ�������������Ԫ�أ���̼��������ѧ��ѧ�о�����Ҫ���ݣ� ̼���γɻ�������������Ԫ�أ���̼��������ѧ��ѧ�о�����Ҫ���ݣ�
̼���γɻ�������������Ԫ�أ���̼��������ѧ��ѧ�о�����Ҫ���ݣ�
 ̼���γɻ�������������Ԫ�أ���̼��������ѧ��ѧ�о�����Ҫ���ݣ�
̼���γɻ�������������Ԫ�أ���̼��������ѧ��ѧ�о�����Ҫ���ݣ� D��̼�����ԭ������Ϊ12.01
D��̼�����ԭ������Ϊ12.01
 ̼���γɻ�������������Ԫ�أ���̼��������ѧ��ѧ�о�����Ҫ���ݣ�
̼���γɻ�������������Ԫ�أ���̼��������ѧ��ѧ�о�����Ҫ���ݣ�