绿矾(FeSO
4?7H
2O)、硫酸亚铁铵(FeSO
4?(NH
4)
2SO
4?6H
2O)是重要的化学化工试剂.工业上常利用机械加工行业产生的废铁屑为原料制备.这种废铁屑中常混有FeS(其它杂质忽略不计),与稀硫酸反应为:FeS+H
2SO
4=FeSO
4+H
2S↑,H
2S有毒,水溶液名称为氢硫酸.
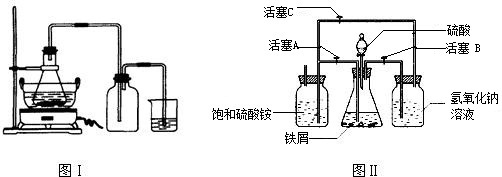
请回答下列问题:
(1)图Ⅰ用于制备绿矾.锥形瓶中反应产生绿矾,其中盛放的药品或原料是
,发生的反应除前述化学方程式外,还一定有 (写化学方程式):
.
若知集气瓶的作用是作安全瓶,烧杯中发生的反应是:CuSO
4+H
2S=CuS↓+H
2SO
4,则烧杯中盛放的试剂是
,其作用为
.
(2)图Ⅱ用于制备硫酸亚铁铵(已知亚铁盐容易被氧化).在0~60℃的温度范围内,硫酸亚铁铵在水中的溶解度比硫酸铵、硫酸亚铁的溶解度小,所以硫酸亚铁与硫酸铵的混合溶液冷却至室温便析出硫酸亚铁铵.
具体操作:①打开活塞
,关闭活塞
,从
(填仪器名称)中滴下稀H
2SO
4到250mL规格的锥形瓶中,充分反应.②待锥形瓶中的铁屑快反应完时,关闭活塞
,打开活塞
.③放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵.
实验中氢气的作用是
,
氢氧化钠溶液的作用是
.
(3)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe
2+被氧化.设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤同,制得硫酸亚铁铵,并对产品质量进行检测.检测结果如下:
| 序号 |
反应物用量(n表示微粒个数) |
产品质量 |
| 1 |
n(H2SO4):n(Fe)>1:1 |
介于1级~Ⅱ级之间 |
| 2 |
n(H2SO4):n(Fe)<1:1 |
优于1级 |
已知产品质量标准:Fe
3+的质量分数等于0.005%,产品质量定为Ⅰ级;Fe
3+的质量分数等于0.01%,产品质量定为Ⅱ级,从实验结果中,可得出制备硫酸亚铁溶液时,反应控制
过量为最佳.
(4)处理胶片的废液中含大量AgNO
3、Zn(NO
3)
2和Fe(NO
3)
2,若随意排放不仅会造成严重的污染,而且造成资源浪费.某同学从上述的废液中回收金属银并得到副产品绿矾(FeSO
4?7H
2O),其回收流程如下:
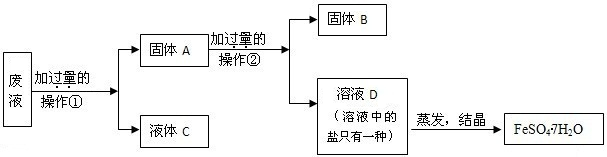
操作②是
,固体A中含
,固体B是
,
x是
,y是
,x、y过量的共同作用是
.
(5)硫酸最古老的生产方法是:把绿矾(FeSO
4?7H
2O)装入反应器中加强热,会流出油状液体,并放出有刺激性气味的气体(SO
2),反应器中的固体变为红色.这个变化的过程可用两个化学方式表示.
①
.
②
.





 名校课堂系列答案
名校课堂系列答案