
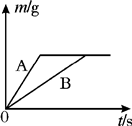
 将等质量的镁粉和铝粉,分别放入质量相等、浓度相同的稀硫酸中,生成H2质量(m)随反应时间的关系如图所示.请回答下列问题:
将等质量的镁粉和铝粉,分别放入质量相等、浓度相同的稀硫酸中,生成H2质量(m)随反应时间的关系如图所示.请回答下列问题: ×金属的质量可知同质量的镁与铝完全反应时铝生成的氢气质量大,故⑤错误;而图象反应两者最终生成的氢气质量相等,则反应时铝必有剩余镁是否有剩余则无法判断,故①②错误;由于反应后生成的氢气质量相等所以消耗的硫酸质量一定相等,而铝有剩余,故两者反应时酸均无剩余,故④正确;依据质量守恒定律,反应后溶液的质量=反应前的总质量-气体的质量-不溶物的质量,图示中生成氢气的质量相等,但剩余的不溶物的质量不同,所以反应结束后所得溶液质量不相等.故③错误;
×金属的质量可知同质量的镁与铝完全反应时铝生成的氢气质量大,故⑤错误;而图象反应两者最终生成的氢气质量相等,则反应时铝必有剩余镁是否有剩余则无法判断,故①②错误;由于反应后生成的氢气质量相等所以消耗的硫酸质量一定相等,而铝有剩余,故两者反应时酸均无剩余,故④正确;依据质量守恒定律,反应后溶液的质量=反应前的总质量-气体的质量-不溶物的质量,图示中生成氢气的质量相等,但剩余的不溶物的质量不同,所以反应结束后所得溶液质量不相等.故③错误;

科目:初中化学 来源: 题型:
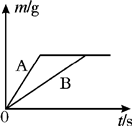 将等质量的镁粉和铝粉,分别放入质量相等、浓度相同的稀硫酸中,生成H2质量(m)随反应时间的关系如图所示.请回答下列问题:
将等质量的镁粉和铝粉,分别放入质量相等、浓度相同的稀硫酸中,生成H2质量(m)随反应时间的关系如图所示.请回答下列问题:查看答案和解析>>
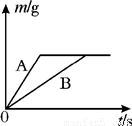
科目:初中化学 来源:2012-2013学年重庆市开县九年级(下)第一次月考化学试卷(解析版) 题型:填空题
查看答案和解析>>
科目:初中化学 来源:2012-2013学年重庆市开县河堰初级中学九年级(下)第一次月考化学试卷(解析版) 题型:填空题

查看答案和解析>>
科目:初中化学 来源:2012-2013学年重庆一中九年级(上)期末化学试卷(解析版) 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com