解:(1)锌和盐酸反应生成氯化锌和氢气,方程式是:Zn+2HCl═ZnCl
2 +H
2↑;盐酸具有挥发性,故制得的气体中混有少量氯化氢气体,而氯化氢气体溶于水形成盐酸可与氢氧化钠溶液反应而被除去,所以可将气体通过氢氧化钠溶液除掉氯化氢气体;
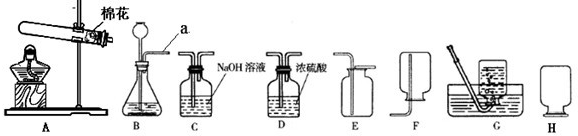
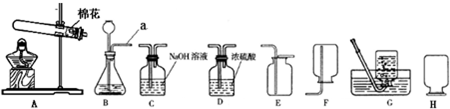
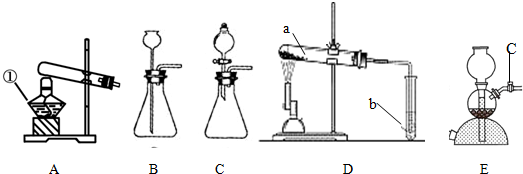
(2)A装置是加热固体制取气体,且试管口有棉花,说明是用加热高锰酸钾的方法制取氧气,氧气密度比空气大,可用向上排空气法收集,方程式是2KMnO
4
K
2MnO
4 +MnO
2 +O
2↑;
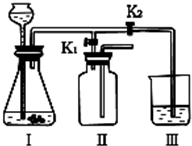
(3)①从图中可以看出Ⅱ中进气管短,说明生成的气体的密度要小于空气的密度.b中所制取的氢气密度小于空气的密度,所以选b;
②二氧化碳溶于水后形成碳酸,碳酸可使紫色石蕊试液变红.我们可利用这一性质检验二氧化碳与水的反应;
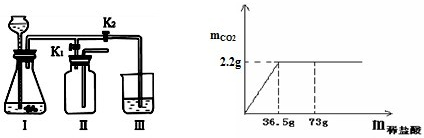
(4)由图象可知:7.5g石灰石样品与稀盐酸反应最多制取二氧化碳气体2.2g;
设7.5克石灰石中碳酸钙的质量为x
CaCO
3 +2HCl═CaCl
2 +H
2O+CO
2↑
100 44
x 2.2g

=
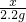
x=5 g
石灰石样品中碳酸钙的质量分数:
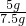
ⅹ100%=≈66.7%
答:该石灰石样品中碳酸钙的质量分数66.7%;
故答案为:(1)Zn+2HCl═ZnCl
2 +H
2↑;盐酸具有挥发性; C;
(2)2KMnO
4
K
2MnO
4 +MnO
2 +O
2↑;
(3)①b;②紫色石蕊试液;
(4)该石灰石样品中碳酸钙的质量分数66.7%.
分析:(1)锌和盐酸反应生成氯化锌和氢气,盐酸具有挥发性,氯化氢气体溶于水形成盐酸可与氢氧化钠溶液反应而被除去;
(2)A装置是加热固体制取气体,且试管口有棉花,说明是用加热高锰酸钾的方法制取氧气,氧气密度比空气大,可用向上排空气法收集,据反应原理书写方程式;
(3)①当打开K
1、关闭K
2时,从图中的收集装置进气管短可看出,制取的气体密度要小于空气的密度;
②利用二氧化碳与水反应形成酸的性质,用石蕊试液检验;
(4)由图象可知:7.5g石灰石样品与稀盐酸反应最多制取二氧化碳气体2.2g,据二氧化碳的质量结合方程式可计算出样品中碳酸钙的质量,进而计算出碳酸钙的质量分数.
点评:本题能综合考查学生对实验室制取氢气、氧气、二氧化碳知识的掌握和应用情况,既考查了相关实验知识,又考查了方程式的基本计算,是一道培养学生思维能力的不错的题目.

 K2MnO4 +MnO2 +O2↑;
K2MnO4 +MnO2 +O2↑; =
=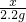
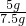 ⅹ100%=≈66.7%
ⅹ100%=≈66.7%  K2MnO4 +MnO2 +O2↑;
K2MnO4 +MnO2 +O2↑;




 装置进行“排空气法”收集制取的CO2,请把图中的“导气管”补画完整.
装置进行“排空气法”收集制取的CO2,请把图中的“导气管”补画完整.