
����Ŀ����ͼ������غ��Ȼ��Ƶ��ܽ�����ߣ������ܽ�����ش��������⡣
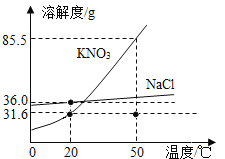
��1������һƿ�ӽ����͵��������Һ��ɱ�����Һ���ɲ�ȡ�ķ���֮һ��_____��
��2����������������Ȼ��ƣ�Ҫ�ᴿ����أ��ɲ���_____�ķ�����
��3��С����100g 20���ˮ�н�������ʵ�飬�õ����Ϊ�٩��ݵ���Һ������˵������ȷ����_____��
![]()
A �������ʵ������������
B �ڢ������ʵ������������
C �٢ۢ���û�й������
D �ڢܢݵ���ҺΪ������Һ
���𰸡���������ع��壨���»������ܼ��ȣ� ���½ᾧ������ȴ�ȱ�����Һ�� ABC
��������
��1�����ݲ�������Һ�뱥����Һ��ת������������
��2�����ݽᾧԭ��������������
��3�������ܽ������������Һ����������Һ���������
��1������ز�������Һ��ɱ�����Һ���� ��������ع��壨���»������ܼ��Ⱥ������ɣ���
��2������ص��ܽ�����¶����߶����������¶�Ӱ��ϴ��Ȼ��Ƶ��ܽ�����¶�Ӱ��仯����������л����Ȼ��ƣ�Ҫ�ᴿ����أ��ɲ��� ���½ᾧ������ȴ�ȱ�����Һ���ķ�����
��3��С����100g 20���ˮ�н�������ʵ�飬�õ����Ϊ�٩��ݵ���Һ������˵������ȷ���� ABC��
20��ʱ����ص��ܽ��Ϊ31.6g����100gˮ�м���20g����صõ���Һ��Ϊ��������Һ���ټ���40g����أ�ֻ�ܽ�11.6g���õ�����Һ��Ϊ������Һ���ټ�����50�棬50��ʱ����ص��ܽ��Ϊ85.5g���õ�����Һ������������Ϊ20g+40g��60g��Ϊ��������Һ���ټ���20g����أ���������������Ϊ20g+40g+20g��80g���õ�����Һ��Ϊ��������Һ��������20��ʱ�����������80g��31.6g��48.4g����Һ��Ϊ������Һ��
A�������������ʵ�������࣬���������������A��ȷ��
B���ڢݶ���20��ʱ�ı�����Һ�����ʵ�����������ȣ�B��ȷ��
C���٢ۢܶ�Ϊ��������Һ��û�й�����ڣ�C��ȷ��
D���ں͢ݵ���ҺΪ������Һ����Ϊ��������Һ��D����
��ѡABC��
�ʴ�Ϊ����1����������ع��壨���»������ܼ��Ⱥ������ɣ��� ��2�����½ᾧ������ȴ�ȱ�����Һ����
��3��ABC��
�ʴ�Ϊ����1����������2��C����3��BD�� ��4��CH4��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������[Ca(ClO)2]��Ư�۵���Ҫ�ɷ�֮һ��������ɱ������������ʯ���Ʊ�������Ƶ���Ҫ�����������£�
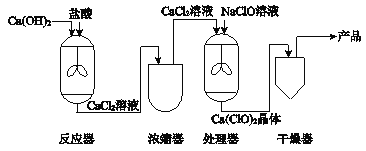
��1��NaClO����Ԫ�صĻ��ϼ���______��
��2���������з����ĸ��ֽⷴӦ�Ļ�ѧ����ʽ��______��
��3�����������У�ֻ�漰�������仯���豸��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ���ҳ��õ�ʵ��װ�ã���ش���������
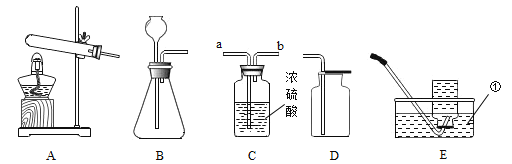
��1���������������� _____��
��2��ʵ������ A װ����ȡ O2����д���йػ�ѧ��Ӧ����ʽ__________������ D װ���ռ���������ԭ���� _____��
��3��ʵ������ȡ���ռ� CO2��ѡ�õ�װ�����Ϊ _____������ĸ����������ҩƷǰ��Ӧ�Ƚ��еIJ�����_________������װ�� C ���� CO2�������ɵ���_________�ˣ�����a������b����ͨ�롣
��4��ijѧУ�о�С��Ϊ̽�����������������̼�ķ�Ӧ��������Ϊ 15��ʱ��ͬѧ�ǽ� 10g �������ƹ�����ȫ�ܽ����� 80g ˮ�У�Ȼ�����ٵ�ͨ�������̼���壬ͬʱ�ô������ⶨ��Һ�� pH �仯�����ݲɼ�����¼�����Ƶ�ͼ������ͼ��ʾ�����������ӣ�Na2CO3+ CO2+H2O= 2NaHCO3��
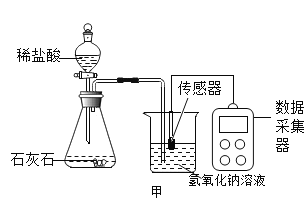
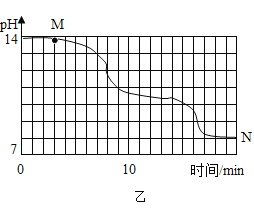
����ͼ����ʾʵ���У�������Һ©����������������©������ԭ���� _____��
����ͼ�� M �㷢������Ҫ��ѧ��Ӧ����ʽΪ _____��
����д����ͼ N ���Ӧ��Һ�е����� _____��
������ʵ���ܵó��Ľ����� _____������ţ���
a��̼��������Һ�Լ���
b������ NaOH ��Һ����ͨ�� CO2 ����������Һ���ճ�����
c����ͬŨ�ȵ� Na2CO3 ��Һ�� NaHCO3 ��Һ�����Դ�С��ϵΪ��Na2CO3> NaHCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڹ��������£�AgNO3�ɷֽ�ΪAg��O2��ij�ֵ���������X��ȡһ��������AgNO3�����ֹ��գ���÷�Ӧ������Ag��O2��X�������ֱ�Ϊ21.6g��mg��9.2g������˵����ȷ���ǣ�������
A. AgNO3����Ӧ�ܷⱣ������ɫϸ��ƿ��
B. m=3.2
C. X�Ļ�ѧʽΪNO
D. �÷�Ӧ����ʽ��Ag��O2�Ļ�ѧ������֮��Ϊ3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����ɫ��ĩ�����ܺ���Ba(OH)2��NaNO3��FeCl3��Na2CO3��Na2SO4�е�һ�ֻ��֡�Ϊ��ȷ����ɷ֣���������ʵ�飺
��ȡһ�����İ�ɫ��ĩ����������ˮ�������ã��ð�ɫ�������ϲ���ҺΪ��ɫ��
�ڹ��ˣ��ڰ�ɫ�����м�������ϡ���ᣬ��ɫ����ȫ���ܽ⣬�������ݲ�����
��1���ݴ��ƶϣ��ð�ɫ��ĩ��һ��������_________��һ������__________�����ܺ���________��
��2��д������ٺ͢��з�����Ӧ�Ļ�ѧ����ʽ��
�� ____________________
��_____________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������[NH4Fe(SO4)2]��һ����Ҫ���Ρ�Ϊ���������Դ�����Ϊ������ʵ������̽�����÷���м���Ʊ�������泥�����������ͼ�����������ͼ�ش��������⡣
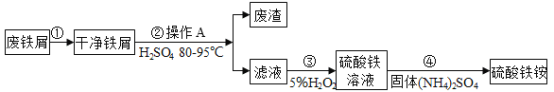
��1������۵Ļ�ѧ����ʽΪ![]() ���������ѧ�仯�����У����ϼ۷����ı��Ԫ��Ϊ��_____��
���������ѧ�仯�����У����ϼ۷����ı��Ԫ��Ϊ��_____��
��2������ܷ������Ϸ�Ӧ��д���÷�Ӧ�Ļ�ѧ����ʽ_____��
��3������ٻ�����ж���SO2��ͼ�����ʺ�����SO2��ֹ��ɿ�����Ⱦ��װ����_____��
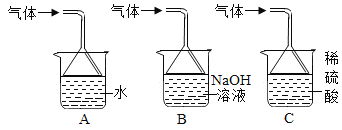
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ��ϡ���ᷢ����Ӧʱ����������Һ��������ʱ��ı仯������ͼ��ʾ������˵����ȷ���ǣ�������
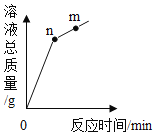
A.��ʵ���ǽ�����ͭ����ϡ������
B.n���m���Ӧ��Һ��ͭԪ�������������
C.n���m���Ӧ��Һ�����ᾧ��õ��Ĺ���ɷ���ͬ
D.�����߲��ܷ�ӳ��Һ���ܼ�������ʱ��ı仯��ϵ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ߴ������������Ӽ��ɵ�·�Ļ������ϡ���ҵ���Ʊ��ߴ���Ļ�ѧ��Ӧԭ��Ϊ����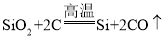 ��
��![]() ��
��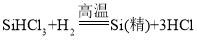 ��Ӧ���Ƶôֹ裬ͨ����Ӧ�ڢ۽�һ���õ��ߴ��衣�����й�˵������ȷ����
��Ӧ���Ƶôֹ裬ͨ����Ӧ�ڢ۽�һ���õ��ߴ��衣�����й�˵������ȷ����
A.��Ӧ�٢ڢ۾�Ϊ�û���Ӧ
B.SiO2��Si�Ļ��ϼ�Ϊ+4��
C.SiHCl3�й衢��Ԫ�ص�������Ϊ 1��3
D.SiHCl3���⡢�衢������Ԫ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����A��C����ѡ���������������𣬰�ǰ�����Ʒ֡�
��� | A | B | C |
ʵ�� װ�� |
|
|
|
���� | ��ʵ���Ŀ����_____�� | ���ô�ʵ��ɹ���֤�����غ㶨�ɣ��Ľ��ķ�����_____�� | ��˵��ͭ���е����Ե�������_____�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com