
【题目】利用如图 所示装置进行实验。①③为潮湿的蓝色石蕊试纸,②为干燥的蓝色石蕊试纸。不考虑盐:酸和水的挥发,回答下列问题:
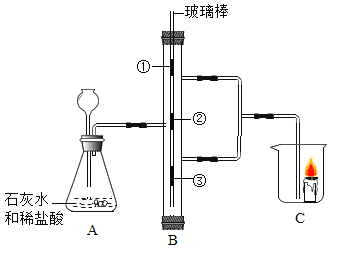
(1)A 装置存在错误,需做的改动是_________;
(2)B 中发生反应的化学方程式为_________;
(3)C 中蜡烛熄灭的原因是 ____________;
(4)对比②③现象可得出的结论是 _________;
(5)整个实验中能说明CO2密度比空气大的现象是 _____________;
(6)实验时加入了含CaCO380%的石灰石 12.5g.理论上最多可生成CO2的体积为多少____? (实验条件下CO2的密度为 2g/L,写出计算过程)
【答案】长颈漏斗下端管口伸到液面以下 ![]() 二氧化碳不燃烧,不支持燃烧 使石蕊变红的是碳酸不是二氧化碳 B装置中③比①先变红 2.2L(详见解析)
二氧化碳不燃烧,不支持燃烧 使石蕊变红的是碳酸不是二氧化碳 B装置中③比①先变红 2.2L(详见解析)
【解析】
(1)在制取二氧化碳时,长颈漏斗要伸入液面以下,以此防止生成的二氧化碳从长颈漏斗下端管口逸出,达不到收集的目的;
(2)在B中二氧化碳与水反应,生成碳酸,化学方程式为![]() ;
;
(3)实验生成的二氧化碳被收集到C中,由于二氧化碳自身不能燃烧也不能支持燃烧,导致C中蜡烛熄灭;
(4)②处放置干燥的蓝色石蕊试纸,③处放置湿润的蓝色石蕊试纸,二氧化碳通过②处时未使②处的石蕊变红,在通过③处与水反应生成酸性的碳酸,使石蕊变红,说明使石蕊变红的是碳酸不是二氧化碳;
(5)由于二氧化碳密度大于空气密度,A中反应开始后二氧化碳先会集聚在B瓶下方,然后逐渐向B瓶上方聚集,③处二氧化碳和水最先反应生成碳酸使石蕊变红;
(6)设生成的二氧化碳质量为x,根据A处石灰石与盐酸反应的化学方程式可得:
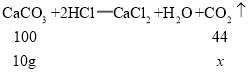
![]() , x=4.4g,
, x=4.4g,
可得生成二氧化碳体积为![]() 。
。


科目:初中化学 来源: 题型:
【题目】25℃时,探究某固体物质的溶解性,实验记录如下表。下列实验结论正确的是
编号 | ① | ② | ③ | ④ |
水的质量/g | 50 | 50 | 50 | 50 |
加入固体质量/g | 5 | 10 | 15 | 20 |
现象 | 固体完全溶解 | 固体完全溶解 | 剩余少量固体 | 剩余较多固体 |
A.实验①所得溶液的溶质质量分数是实验②的一半
B.在实验④中再加入 50g水后,溶液的溶质质量分数为 15%
C.由表格中的数据可以确定 25℃时该物质的溶解度大小的范围是:20 g≤S<30g
D.实验②中温度由 25℃冷却到 10℃时,一定有固体析出
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳酸锂是一种重要的锂盐,广泛应用于锂离子电池生产中。工业上可以用锂辉石精矿(主要成分是Li2O、含有Al2O3、SiO2等杂质) 为原料制取高纯的碳酸锂。某校化学活动小组收集了碳酸锂的溶解度数据如表:
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度(g) | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
设计了制取碳酸锂的工艺流程(如图):
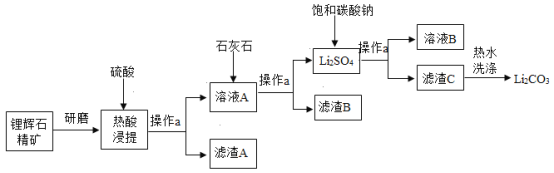
请回答:
(1)操作a所需的玻璃仪器有烧杯、玻璃棒和_____。
(2)热酸浸提中可能发生反应的化学方程式:
①_____;
②Li2O+H2SO4=Li2SO4+H2O。
(3)“洗涤”滤渣C时应该使用热水,其原因是_____。
(4)为了探究热酸浸提的最佳条件,将矿石在一定条件下酸浸4小时,测量锂元素浸出率的部分数据如表:
编号 | 矿酸比 | 硫酸浓度(%) | MgSO4用量(g) | 温度(℃) | 锂元素浸出率(%) |
1 | 1:1 | 90 | 0.00 | 100 | 70.34 |
2 | 1:1 | 98 | 0.00 | 100 | 73.89 |
3 | 1:1 | 98 | 0.00 | 150 | 78.24 |
4 | 1:3 | 98 | 0.00 | 200 | 85.53 |
5 | 1:3 | 98 | 1.25 | 250 | 90.26 |
6 | 1:3 | 98 | 2.50 | 250 | 95.88 |
①对比分析编号1和编号2的实验数据,可以得到的结论是_____。
②有同学想在实验6的基础上,从降低成本角度继续研究提高锂元素的浸出率,下面设计合理的是_____。
A 矿酸比1:2,硫酸浓度98%,MgSO4用量0.00,温度150℃
B 矿酸比1:2,硫酸浓度98%,MgSO4用量2.50,温度200℃
C 矿酸比1:2,硫酸浓度98%,MgSO4用量2.50,温度250℃
D 矿酸比1:3,硫酸浓度98%,MgSO4用量2.00,温度250℃
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为及时发现燃气泄漏,常在燃气中加入少量有特殊气味的乙硫醇(C2H5SH),乙硫醇燃烧的化学方程式为2C2H5SH+9O2![]() 4CO2+2X+6H2O。下列关于X的说法正确的是
4CO2+2X+6H2O。下列关于X的说法正确的是
A.X的化学式是SO3
B.X中氧元素的质量分数为50%
C.X由碳、硫、氧三种元素组成
D.X中硫元素与氧元素的质量比为1:2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组将光亮铜片放在酒精灯火焰上灼烧,发现表面变黑,他们对黑色物质来源产生了兴趣,对铜片表面黑色物质的成分进行探究:
(查阅资料)(1)酒精不充分燃烧产生炭黑(即烟灰);
(2)氧气的化学性质比较活泼,加热条件下能与金属铜反应生成黑色的氧化铜。
(猜想与假设)
甲认为: ____________。
乙认为:铜片表面的黑色固体是空气中的氧气与铜反应生成的新物质。
丙认为:铜片表面的黑色固体既有烟灰又有氧气与铜反应生成的新物质。
(进行实验)
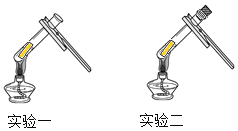
实验步骤和方法 | 实验现象 | 实验结论 |
实验一:取一小段光亮铜片,放入试管内,然后用试管夹夹持试管,放在酒精灯的外焰部位加热。 | 铜片变黑 | 甲、丙的猜想错误。说明黑色物质的出现可能与空气中的________有关。 |
实验二:取一试管,将一小段光亮铜片放入试管中,塞上胶塞,并用注射器抽出试管内的空气,封好胶塞,并加热,趁热取下胶塞,观察现象。 | 取下胶塞前的现象: _____。取下胶塞后的现象:___。 | 乙的猜想正确 |
(反思拓展)
(1)实验一将铜片放入试管中加热,目的是排除了______的干扰。
(2)实验二用注射器抽出试管内空气的目的是________。
(3)通过对黑色物质来源的探究,写出金属铜与氧气反应的化学方程式_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】嗅盐(如图 )是由易分解的铵盐类物质和香料组成。释放出的氨气对人体神经会产生产生强烈的刺激作用,广泛应用于体育比赛中。同学们对嗅盐成分展开探究 (已知香料不参与下列探究中的任何反应)。

定性初探:嗅盐中含有什么盐类物质?
(猜想假设)
①碳酸铵:原因是碳酸铵晶体受热易分解产生NH3、H2O、CO2。
②碳酸氢铵:原因是(用化学方程式表示) ___。
③....
(查阅资料)
①氯化钙稀溶液与碳酸氢铵稀溶液不发生反应。
②NH3极易溶于水,难溶于植物油和四氯化碳(一种密度比水大的有机溶剂)。
(实验探究)
(1)阳离子验证:取少量样品放入试管中,加水溶解,加入氢氧化钠溶液共热,在试管口放一张__, 观察到预期的实验现象。
(2)阴离子验证:
①取少量样品放入试管中,滴加足量稀盐酸,将产生气体通入___,溶液变浑浊。
②取少量样品放入试管中,加水溶解,取上层清液加入氯化钙稀溶液,产生白色沉淀。
(初步结论)仅根据实验探究,嗅盐中一定含有的盐是___。
II.定量再探:嗅盐中氮元素含量是多少?
(设计方案)甲同学设计了如图的实验方案(加热及固定装置已省略,本实验状况下铵根离子可完全转化为NH3,NH3密度为0.7g/L)。 经过交流讨论,同学们认为有以下两处需要改进。
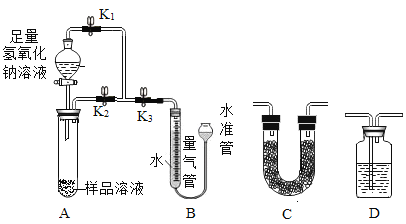
(1)欲使实验成功进行,装置B中药品需要作的改动是___。
(2)欲使实验结果精确,在装置与B之间K3处应添加的仪器较合适的是___。(选填“C”或“D”)。
(进行实验)取样品 1.0 克配成溶液进行实验,装置B中量气管在实验前后的液面差为 242.9mL。
(实验结论)嗅盐中氮元素的质量分数为___。
(反思拓展)若其他操作均正确,下列会导致所测氮元素的质量分数偏小的是__。(填字母)。
a 实验开始,量气管内液面低于量气管顶端的0刻度线
b 反应结束,调节水准管使装置B两端液面相平后读数
c 反应结束,未等装置冷却到室温就开始读取气体体积
d 反应前正确读取量气管中气体体积,反应后俯视读数
e 实验进行过程中,弹簧夹K1、K2始终处于打开状态
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】BMH[化学式为Mg2ClO(OH)3·H2O]是一种白色粉末。难溶于水,是常用的无机抗菌剂。BMH的一种生产工艺如图所示。
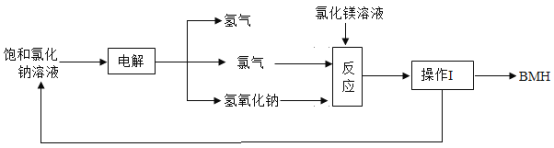
(1)BMH中氯元素的化合价为____价。
(2)流程中操作I的名称为_____。
(3)流程中“反应”步骤生成BMH的化学方程式为_____。
(4)该流程中除水外,可循环利用的物质是_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有A、B、C、D四种元素,A元素是人体中含量最多的元素,B元素形成的单质是空气中含量较多且化学性质不活泼的气体,C2+的核外有两个电子层,D元素是人体必需的一种微量元素,如缺少将导致贫血。试回答:
(1)A元素的名称是:_____。
(2)B元素形成的单质的化学式:_____。
(3)D元素的单质在氧气中燃烧的化学方程式为:_____。
(4)A、B、C三种元素组成的化合物的化学式:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列实验方案的设计中,没有正确体现对比这种科学思想的是
A. 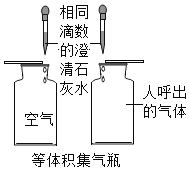 比较二氧化碳的含量
比较二氧化碳的含量
B. 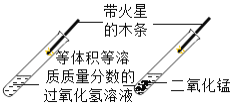 研究二氧化锰的催化作用
研究二氧化锰的催化作用
C.  区分硬水和软水
区分硬水和软水
D. 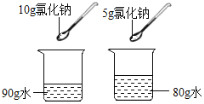 比较氯化钠溶解的快慢
比较氯化钠溶解的快慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com