在12.4克硫酸钠及碳酸钠的混合物,加入适量的水溶解,在该混合溶液中加入稀硫酸后有气体放出,直到不再产生气体时为止,用去稀硫酸溶液49克,已知H2SO4的质量分数为10%;在反应后的溶液中继续加入足量的氯化钠溶液,有白色沉淀生成.求:
(1)加入稀硫酸后生成硫酸钠的质量;(2)加入氯化钠溶液后,生成白色沉淀的质量.
【答案】
分析:根据题给信息可以知道发生的反应为碳酸钠和稀硫酸的反应,可以根据消耗的硫酸的质量来解答;当向反应后的溶液中加入氯化钡时发生的是硫酸钠和氯化钡的反应,可以根据硫酸钠的质量求算.
解答:解:(1)设反应消耗碳酸钠的质量为x,生成硫酸钠的质量为y
Na
2CO
3+H
2SO
4═Na
2SO
4+H
2O+CO
2↑
106 98 142
x 49g×10% y
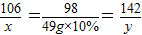
解得:x=5.3g y=7.1g
所以反应后硫酸钠的总质量为:12.4g-5.3g+7.1g=14.2g
(2)设生成硫酸钡的质量为z,
Na
2SO
4+BaCl
2=2NaCl+BaSO
4↓
142 233
14.2g z
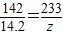
解得:z=23.3g
答:(1)加入稀硫酸后生成硫酸钠的质量为7.1g;
(2)加入氯化钠溶液后,生成白色沉淀的质量为23.3g
点评:根据化学方程式可以表示反应中各物质的质量比,由反应中某物质的质量可计算中反应中其它物质的质量.



 教学练新同步练习系列答案
教学练新同步练习系列答案