通过学习,同学们已经知道,碱是一类物质的总称.
(1)氢氧化钠和氢氧化钾(化学式KOH)的性质很相似.如:a、纯净的氢氧化钾是白色固体;b、它极易溶解于水;c、氢氧化钾固体露置于空气中易吸水而潮解;d、氢氧化钾能吸收空气中的二氧化碳;e、氢氧化钾和硫酸铜溶液混合可以制得氢氧化铜.根据上面短文的内容,运用你学过的有关知识填空:
①从上面的短文中得知,氢氧化钾的物理性质为(填符号)______.
②写出上面短文中涉及到的与氢氧化钾的化学性质有关的反应的化学方程式.______,______.
③根据氢氧化钾的性质,你认为氢氧化钾固体的保存方法应是______.
(2)小刚走进化学实验室,发现了一瓶敞口放置的固体氢氧化钠,他猜测药品已部分变质为碳酸钠了.
①请你和小刚一起分别选用酸、碱、盐三种不同类别的物质做试剂,检验氢氧化钠已变质______、______、______.
②选上述任一试剂检验,简述实验步骤、现象及结论.
(3)碱和酸会发生中和反应.
①请举一例中和反应在日常生活中的具体应用______.
②某化学兴趣小组为了测定一工厂废水中硫酸的含量,取水样于烧杯中,加入120g质量分数为10%的氢氧化钠溶液,恰好完全反应(废水中其他成分不与氢氧化钠反应).请计算:水样中硫酸的质量为多少?
解:(1)①氢氧化钾的颜色、状态、水溶性、吸水性等方面的性质属于物理性质.故填:abc;
②氢氧化钾和二氧化碳反应能生成碳酸钾和水,用观察法配平,所以化学方程式为:2KOH+CO
2═K
2CO
3+H
2O;
氢氧化钾和硫酸铜反应能生成氢氧化铜和硫酸钾,用观察法配平,氢氧化铜后面标上沉淀符号,所以化学方程式为:2KOH+CuSO
4═Cu(OH)
2↓+K
2SO
4;
③因为氢氧化钾容易吸收二氧化碳和水,所以应该密封保存.故填:密封保存.
(2)氢氧化钠变质是氢氧化钠与二氧化碳反应生成碳酸钠和水,验证是否变质主要看一下是否含有碳酸根,既可以通过加入酸看是否产生气体,例如加入稀盐酸,如果有气泡已经变质,否则没有变质,也可以加入试剂与碳酸钠反应产生沉淀例如加入氯化钙、氢氧化钙,有沉淀生成说明已经变质,否则没变质.实验步骤:取少量待测固体放入试管内,向试管内滴加稀盐酸,如果有气泡产生,说明已经变质,如果没有气泡产生,说明没有变质;
(3)①用胃舒平治疗胃酸过多,就是利用氢氧化铝与盐酸反应生成氯化铝和水,属于中和反应;
②设与120g质量分数为10%的氢氧化钠溶液反应消耗硫酸的质量为X则:
2NaOH+H
2SO
4 ═Na
2SO
4 +2H
2O
80 98
120g×10% X
根据
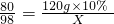
解得X=14.7g.
故答案为:(1)①abc;②2KOH+CO
2═K
2CO
3+H
2O;2KOH+CuSO
4═Cu(OH)
2↓+K
2SO
4;③密封保存;(2)①稀盐酸;氢氧化钙;氯化钙;②取少量待测固体放入试管内,向试管内滴加稀盐酸,如果有气泡产生,说明已经变质,如果没有气泡产生,说明没有变质;(3)①用胃舒平治疗胃酸过多;②14.7g.
分析:(1)需要通过化学变化表现出来的性质属于物质的化学性质,不需要通过化学变化表现出来的性质属于物质的物理性质.根据反应物和生成物及其质量守恒定律可以书写化学方程式;(2)氢氧化钠变质是氢氧化钠与二氧化碳反应生成碳酸钠和水,主要看一下是否含有碳酸根,既可以通过加入酸看是否产生气体,也可以加入试剂与碳酸钠反应产生沉淀,要根据实验的设计方法进行实验叙述;(3)①中和反应是指酸与碱反应生成盐和水的反应;②通过方程式根据氢氧化钠的质量计算出消耗硫酸的质量.
点评:本题容易出错的地方是除杂质,加入的试剂只能与杂质反应,不能与需要的物质反应,不能引入新的杂质,要用酸、碱、盐三种不同类别物质进行鉴别.

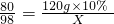 解得X=14.7g.
解得X=14.7g.

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案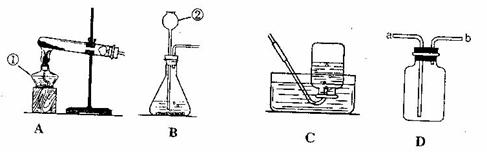 通过学习,同学们已经掌握了实验室制取气体的有关知识,请结合下列装置图,回答问题:
通过学习,同学们已经掌握了实验室制取气体的有关知识,请结合下列装置图,回答问题: