
【题目】请沿用科学家认识事物的方式认识“空气”。
⑴从分类角度:空气属于___________________(填“混合物”或“纯净物”)。
⑵从微观角度:用“![]() ”表示氮原子,“
”表示氮原子,“![]() ”表示氧原子。
”表示氧原子。
①用“![]() ”可表示的微粒是____________________(填名称)。
”可表示的微粒是____________________(填名称)。
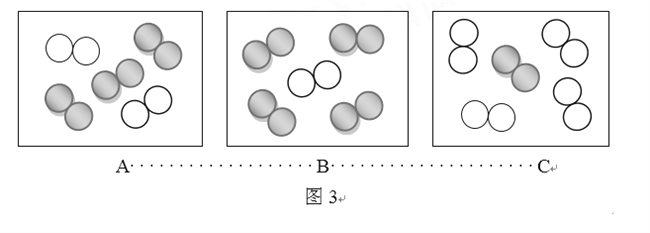
②同温同压下,气体的体积比等于分子数目比。若空气中其它成分忽略不计,图3可表示空气微观模型的是__________(填标号)。
⑶从变化角度:已知:常压下,氮气沸点-196℃,氧气沸点-183℃。将燃着的木条置于盛满液态空气的烧杯口,观察到的现象是______________________________________________________。将该烧杯放置一段时间后,液态物质剩余约1/10体积,其主要成分是_______________。
(4)从应用角度:利用空气制取氮肥的流程如图4所示。
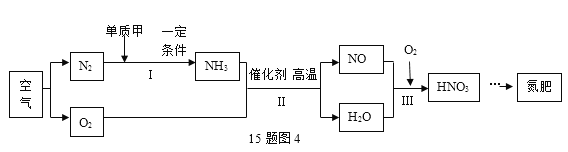
①Ⅰ中参加反应的单质甲为____________。
②Ⅱ中反应的化学方程式为____________________________。
③物质所含元素化合价发生变化的反应称为氧化还原反应。反应Ⅲ_____________(填“属于”或“不属于”)氧化还原反应。
⑸从环保角度:下列保护空气措施合理的是_______(填标号)。
A.工厂通过加高烟囱直接排放废气
B.推广使用乙醇汽油代替普通汽油
C.提倡步行、骑自行车等“低碳”出行方式
【答案】 混合物 。 (一个)氮(气)分子 。 C 。 木条熄灭 ; 氧气(O2) 。 氢气(H2) 。 4NH3+5O2 4NO+6H2O 。 属于 。 B、C 。
4NO+6H2O 。 属于 。 B、C 。
【解析】(1)空气中含有多种物质,故是混合物;
(2)①“![]() ”表示1个氮气分子;②A。中氮气占2/5,氧气占3/5,而空气中氮气约占4/5,氧气约占1/5,错误;
”表示1个氮气分子;②A。中氮气占2/5,氧气占3/5,而空气中氮气约占4/5,氧气约占1/5,错误;
B、B图中表示氧气占4/5,氮气占1/5,错误;
C、C图中表示氧气占1/5,氮气占4/5,,正确;故选C。
③由题可知,氮气的沸点比氧气的沸点低,故打开液态空气的瓶口时,瓶口先挥发出来的是氮气,故燃着的木条熄灭;氮气占空气体积的4/5,故最终剩余1/10的物质是氧气;
(4)①氮气语音单质甲反应后生成的是氨气,根据质量守恒定律,单质甲是氢气;②氨气与氧气在高温催化剂的条件下反应生成一氧化氮和水,反应方程式为4NH3+5O2 4NO+6H2O ③该反应中有氧气单质参加了反应,故氧元素的化合价一定发生改变,故属于氧化还原反应;
4NO+6H2O ③该反应中有氧气单质参加了反应,故氧元素的化合价一定发生改变,故属于氧化还原反应;
(5)A、工厂通过加高烟囱直接排放废气,不能减少环境污染,错误;
B、乙醇汽油代替普通汽油可以减少环境污染,正确;
C、提倡步行、骑自行车等“低碳”出行方式可以减少环境污染,正确。故选BC.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:初中化学 来源: 题型:
【题目】结合如图所示验证氢氧化钙化学性质的实验图示,回答有关问题.
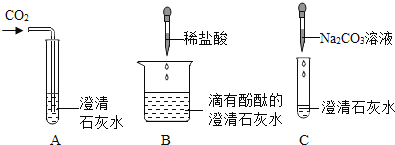
(1)实验A中,一定能够观察到的明显现象是________;
(2)实验B验证了氢氧化钙能跟酸、_______作用;
(3)实验C中发生的反应可用化学方程式表示为_______________;
(4)已知Na2CO3溶液呈碱性,将A、B、C三个实验后的所有物质倒入同一个烧杯中,发现有气泡产生,最后只得到了无色溶液,则最后得到的无色溶液中一定含有的溶质是____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学测定一瓶标签残缺的硫酸镁溶液的溶质质量分数,取30g该溶液,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液。生成沉淀的质量与所用氢氧化钠溶液的质量关系下图所示。已知:MgSO4+2NaOH=Na2SO4+Mg(OH)2↓。
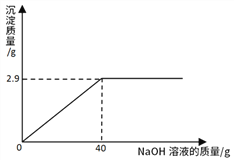
(1)配制40g溶质质量分数为10%的NaOH溶液,需NaOH的质量=_______g。
(2)计算MgSO4溶液中溶质的质量分数为________________(列式计算)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】CaCO3在生产生活中有广泛的用途.
(1)煅烧石灰石可制得活性CaO,反应的化学方程式为___________。为测定不同煅烧温度对CaO活性的影响,某化学兴趣小组进行了如下实验:
Ⅰ.取石灰石样品分为三等份,在同一设备中分别于800℃、900 ℃和1000℃条件下煅烧;
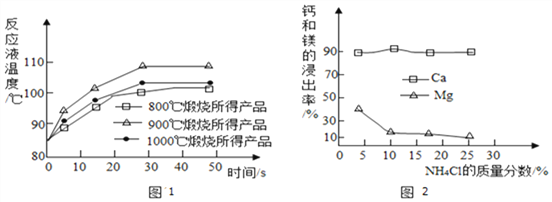
Ⅱ.所得固体分别与等质量的水完全反应,测得反应液温度随时间的变化如图1所示。上述温度中,___________℃时煅烧所得CaO活性最高。
(2)以电石渣(主要成分为Ca(OH)2,还含有少量MgO等杂质)为原料制备高纯活性CaCO3的流程如图3。(资料:氨水的pH约为11.7,氢氧化镁完全沉淀的pH约为10.87)
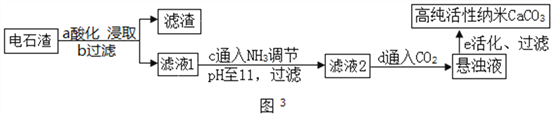
①步骤a中加入的药品为NH4Cl溶液,由此说明NH4Cl溶液呈________性(填酸性、中性或碱性);如图2为浓度对钙、镁元素浸出率的影响。由图可知NH4Cl溶液的质量分数达到10%以上主要溶解的是Ca(OH)2;浸取时主要发生反应的化学方程式为_________________。
②流程c通入NH3的目的主要有两个,一是调节溶液的pH值,二是_______。
③滤液1中通入NH3和CO2后生成碳酸钙和氯化铵,写出发生反应的化学方程式为________________。
④向滤液1中滴加Na2CO3溶液,也能得到CaCO3,从节约药品角度分析图3所示流程中可循环利用的物质有__________________(写出两种物质)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学实验探究总是能引起同学们的兴趣。某化学兴趣小组在实验室实验时发现了一瓶标签缺损的溶液,如下图。为了确认其溶质成分,同学们进行了如下探究:
(提出猜想)猜想一:NaCl; 猜想二:Na2CO3;猜想三: NaHCO3 猜想四:NaOH
(设计实验一)
小明取少量溶液样品于试管中,用玻璃棒蘸取溶液滴在pH试纸上,读取数据,pH=9,得出结论,猜想四成立。
小王认为小明的结论不准确,理由是:________________。
从小明的实验结果中可以判断出猜想_________也一定是错误的。
(设计实验二)小红取适量稀盐酸于试管中,滴加少量此溶液,溶液中产生气泡。于是认为猜想二正确。
小王认为仍然不能确定,理由是_______________。
(查阅资料)常温下,碳酸钠和碳酸氢钠的溶解度为以下表格中的数据。
Na2CO3 | NaHCO3 | |
溶解度/g | 21.8 | 9.6 |
(分析结论)从资料显示的数据,再结合药品的标签,可以判断猜想_________不正确,理由是_____________________。
(问题交流)(1)Na2CO3和 NaHCO3在生活中被称为“苏打兄弟”,其中NaHCO3在生活中可用来_______________ (写出一条即可)。
(2)Na2CO3在空气中长期放置,会吸收空气中水蒸气和另一种气体而转变成 NaHCO3。请你写出反应方程式________________________。
[注意:若答对以下问题可奖励4分,化学试卷总分不超过60分。]
兴趣小组和老师一起继续实验,将盐酸滴加到Na2CO3溶液中进行反应,并用数字化实验装置pH传感器测定了溶液中pH的变化。采集数据得到曲线如下图所示。
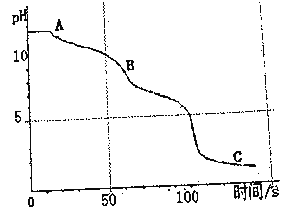
(3)0-50s时,同学们观察到溶液中并没有想象中的气泡产生,请你写出AB段发生反应的化学方程式:__________________。
(4)B点溶液pH大于7,是因为___________(填物质名称)的水溶液呈碱性。
(5)C点所得溶液的溶质是__________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列 4 个图像能正确反映对应变化关系是( )
A | B | C | D |
|
|
|
|
向一定量稀硫酸中加 入 NaOH 溶液 | 浓硫酸长期暴露在空 气中 | 向一定量的硫酸溶液 中逐滴滴入氢氧化钡 溶液至过量 | 相同条件下,加热质 量相等的两份固体,a 为氯酸钾和二氧化锰 的混合物,b 为氯酸 钾 |
A. A B. B C. C D. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在化学反应前后,物质所含元素化合价发生变化的反应属于氧化还原反应。氧化还原反应与四种基本化学反应类型间的关系如图所示,下列举例中错误的是:
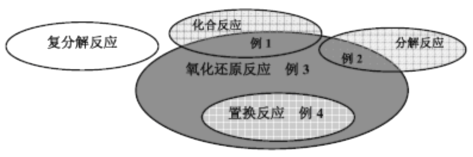
A.例l: C+O2![]() CO2 B.例2:2H2O
CO2 B.例2:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
C.例3: Mg(OH)2+2HCl=MgCl2+2H2O D.例4: Cu+2AgNO3=2Ag+Cu(NO3)2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将4.0g Cu-Zn合金粉末放到盛有10g稀硫酸的烧杯中,恰好完全反应。过滤、称量滤液的质量。相关实验数据如下:
反应前物质的质量/g | 反应后物质的质量/g | |
Cu-Zn合金 | 稀硫酸 | 固体和液体的总质量 |
4.0 | 10 | 13.96 |
若不考虑该合金中除Cu、Zn以外的其他成分,请计算
(1)原Cu-Zn合金中Zn的质量为___________。
(2)所用稀硫酸中溶质的质量分数为___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯化钾的溶解度曲线如图所示。下列说法正确的是
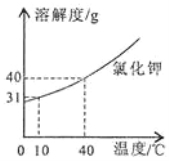
A.升高温度可使接近饱和的氯化钾溶液变为饱和溶液
B.10℃时,65.5g氯化钾的饱和溶液中加入5g氯化钾,充分溶解后将温度升高到40℃,得到70g氯化钾饱和溶液
C.50g水中加入20g氯化钾充分溶解,形成氯化钾饱和溶液
D.40℃时,氯化钾饱和溶液中溶质的质量分数为40%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com