
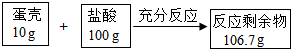
 鸡蛋壳的主要成分是碳酸钠(其他成分不与酸反应,也不溶于水),为了测定鸡蛋壳中碳酸钙的质量分数,进行如下实验.请回答相关问题:
鸡蛋壳的主要成分是碳酸钠(其他成分不与酸反应,也不溶于水),为了测定鸡蛋壳中碳酸钙的质量分数,进行如下实验.请回答相关问题:分析 (1)根据质量守恒定律可以知道,该反应中反应前后质量减少的为二氧化碳,故可以求出二氧化碳的质量;
(2)根据二氧化碳的质量可以求出碳酸钙的质量进而求出碳酸钙的质量分数.
解答 解:(1)生成二氧化碳的质量为:10g+100g-106.7g=3.3g;
(2)设鸡蛋壳中CaCO3的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 3.3g
$\frac{100}{x}$=$\frac{44}{3.3g}$
x=7.5g
鸡蛋壳中CaCO3的质量分数为:$\frac{7.5g}{10g}$×100%=75%.
故答案为:(1)生成CO2气体的质量3.3g;
(2)鸡蛋壳中CaCO3的质量分数75%.
点评 利用质量守恒定律求出反应放出二氧化碳的质量,然后根据二氧化碳的质量来求出碳酸钙的质量,进而求出质量分数,注意求反应后溶质的质量分数的方法--关键是求出反应后溶液的质量.


科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 在学习“二氧化碳性质的探究”时,小刘同学将二氧化碳通入紫色石蕊溶液中,发现变红了,是什么使紫色石蕊变为红色的呢?他和小红同学进行了如下实验探究:
在学习“二氧化碳性质的探究”时,小刘同学将二氧化碳通入紫色石蕊溶液中,发现变红了,是什么使紫色石蕊变为红色的呢?他和小红同学进行了如下实验探究:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com