
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
| NaOH | 31 | 91 | 111 | 129 | 313 | 336 | |
分析 (1)根据表格中的数据判断;
(2)根据表格中20℃时,NaOH的溶解度解答;
(3)不饱和溶液变为饱和溶液的一般方法是:增加溶质,蒸发溶剂,降低温度,并结合Ca(OH)2的溶解度随温度变化情况分析解答;
(4)Ca(OH)2的溶解度随温度的升高而减小,并结合饱和溶液溶质的质量分数计算式分析解答;
(5)根据氢氧化钙的溶解度随温度的升高而减小,氢氧化钠的溶解度随温度的升高而增大判断;
解答 解:(1)从表格中的数据可知氢氧化钙的溶解度随温度的升高而减小;
(2)表格中14g20℃时,NaOH的溶解度为91g;
(3)Ca(OH)2的溶解度随温度的升高而减小,所以要使其不饱和溶液变为饱和溶液可采取增加溶质、蒸发溶剂、升温的方法,生石灰溶于水和水反应且放热使溶液温度升高,其溶解度减小,也可使不饱和溶液变为饱和溶液,故选D;
(4)Ca(OH)2的溶解度随温度的升高而减小,将20℃时Ca(OH)2的饱和溶液甲溶液降温至0℃得到乙溶液,此过程中溶液中溶质溶剂均未变化,所以
两种溶液中溶质的质量分数相等;
(5)氢氧化钙的溶解度随温度的升高而减小,氢氧化钠的溶解度随温度的升高而增大,降温氢氧化钠结晶析出,氢氧化钙溶解度增大不会结晶析出,然后过滤即可得到纯净的氢氧化钠;
故答案为:
(1)Ca(OH)2
(2)91g;(3)D;(4)=;(5)降温结晶并过滤
点评 了解Ca(OH)2、NaOH溶解度的溶解度随温度的变化情况,并能据所学知识正确分析解答,本题重在考查对知识的掌握和应用.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题

| 实验步骤 | 实验现象 | 结论 |
| 取图2实验中A瓶反应后所得的溶液少许于试管中,再向试管中滴加稀盐酸溶液 | 有气泡产生 | 验证了二氧化碳和氢氧化钠溶液发生了反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
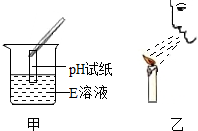 甲、乙两位同学做如下两个实验,请回答:
甲、乙两位同学做如下两个实验,请回答:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
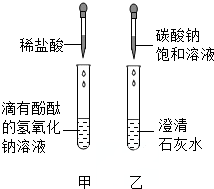 同学们在学碱的化学性质时,做了如图所示的甲、乙两个实验.
同学们在学碱的化学性质时,做了如图所示的甲、乙两个实验.| 实验内容 | 预计现象 | 预计结论 |
| 取少量废液缸中上层清液于试管 中,加入过量氯化钙溶液,静置. | ①有白色沉淀,溶液呈红色. | 小林的猜想正确. |
| ②产生白色沉淀、溶液为无色. | 小刚的猜想正确. | |
| ③无白色沉淀,溶液呈红色. | 小红的猜想正确. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  向氢氧化钠溶液中不断加水,溶液pH与加入水的质量的关系 | |
| B. |  向盛有氧化铜的烧杯中加入稀盐酸至过量,生成氯化铜质量与加入稀盐酸质量的关系 | |
| C. |  一定量的稀硫酸与锌粒反应,溶液的质量与反应时间的关系 | |
| D. |  向盛有硫酸铜和硫酸溶液的烧杯中滴加氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的质量关系 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 是硒离子(Se2-)的结构示意图.
是硒离子(Se2-)的结构示意图.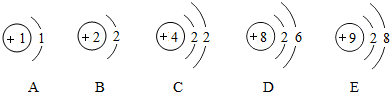
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 铁锅、铝锅是生活中常用的炊具,如图是铁锅的示意图.
铁锅、铝锅是生活中常用的炊具,如图是铁锅的示意图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com