
分析 化学方程式可表示:反应物和生成物的种类;反应的条件;反应物和生成物的微观粒子个数比;反应物和生成物的质量比等.但要注意读化学方程式时,“+”应读作“和”,“═”应读作“生成”.
解答 解:化学方程式C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2,可表示碳和氧气在点燃条件下生成二氧化碳;从微观上,点燃条件下,每1个碳原子和1个氧分子反应生成1个二氧化碳分子;每12份质量的碳和32份质量的氧气在点燃条件下恰好完全反应生成44份质量的二氧化碳.
故答案为:①碳和氧气在点燃条件下生成二氧化碳;②点燃条件下,每1个碳原子和1个氧分子反应生成1个二氧化碳分子;③每12份质量的碳和32份质量的氧气在点燃条件下恰好完全反应生成44份质量的二氧化碳.
点评 本题难度不大,化学方程式是最重要的化学用语之一,掌握化学方程式的含义、了解方化学程式的读法是正确解答此类题的关键.


科目:初中化学 来源: 题型:选择题
| A. | 3.65% | B. | 7.3% | C. | 14.6% | D. | 29.2% |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
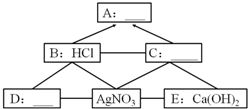 A、B、C、D、E分别表示常见的单质、氧化物、酸、碱、盐中的各一种物质.它们之间的转化关系如图(“-”表示物质之间能反应,“→”表示物质间能转化).
A、B、C、D、E分别表示常见的单质、氧化物、酸、碱、盐中的各一种物质.它们之间的转化关系如图(“-”表示物质之间能反应,“→”表示物质间能转化).查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
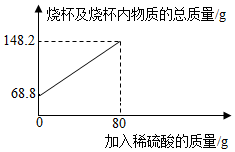 为测定某碳素钢样品中铁的质量分数,现取一定质量的样品粉末于质量为51.8g的烧杯中,然后逐步加入一定质量分数的稀硫酸,当加入80g稀硫酸时反应恰好完全,加入稀硫酸的质量与烧杯及烧杯内物质的总质量的关系如图.试通过计算完成下列填空:(不能整除时,结果保留一位小数)
为测定某碳素钢样品中铁的质量分数,现取一定质量的样品粉末于质量为51.8g的烧杯中,然后逐步加入一定质量分数的稀硫酸,当加入80g稀硫酸时反应恰好完全,加入稀硫酸的质量与烧杯及烧杯内物质的总质量的关系如图.试通过计算完成下列填空:(不能整除时,结果保留一位小数)查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com