
分析 (1)化合物中元素的质量分数=$\frac{相对原子质量×原子个数}{相对分子质量}$×100%,据此进行分析解答.
(2)根据溶质质量=溶液质量×质量分数,进行分析解答.
(3)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.
解答 解:(1)尿素中氮元素的质量分数为$\frac{14×2}{12+16+(14+1×2)×2}×$100%≈46.7%.故答案为:46.7%.
(2)配制1000千克含尿素6%的营养液,需要尿素质量为1000kg×6%=60kg,故填:60kg,
(3)设60kg尿素中含氮量与x质量的硫酸铵中含氮量相同,
60kg×$\frac{14×2}{12+16+(14+2)×2}$×100%=x×$\frac{14×2}{(14+1×4)×2+32+16×4}$×100%
x=132kg
答:需要132kg的硫酸铵.
点评 本题难度不大,主要考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.


 口算能手系列答案
口算能手系列答案科目:初中化学 来源: 题型:选择题
| A. | $\frac{m+2n-e}{2}$ | B. | m+2n-e | C. | m+n-2e | D. | m+n-e |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 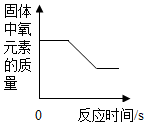 加热一定质量的氯酸钾与二氧化锰的混合物 | |
| B. | 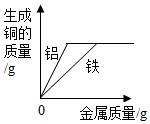 将过量的铝和过量的铁同时加入某硫酸铜溶液中 | |
| C. | 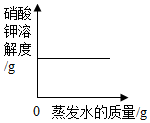 恒温条件下,将接近饱和的硝酸钾溶液蒸发一定质量的水 | |
| D. | 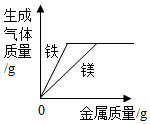 将过量的铁和过量的镁分别放入两份等质量、等质量分数的稀硫酸中 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 目的 | 主要实验操作 |
| A | CO、CH4气体 | 鉴别 | 点燃,火焰上方罩干冷烧杯,观察现象 |
| B | Na2CO3(NaOH)溶液 | 检验 | 滴加酚酞试液,观察溶液颜色的变化 |
| C | CaO(CaCO3)固体 | 除杂 | 充分加热至固体质量不变 |
| D | MnO2、KCl 固体 | 分离 | 溶解、过滤、洗涤、烘干、蒸发 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 阿司匹林是防止心血管病发生的常用药物,它具有抗血栓防止心肌梗塞等作用.阿司匹林又称乙酰水杨酸,化学式为C6H13O5N.
阿司匹林是防止心血管病发生的常用药物,它具有抗血栓防止心肌梗塞等作用.阿司匹林又称乙酰水杨酸,化学式为C6H13O5N.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
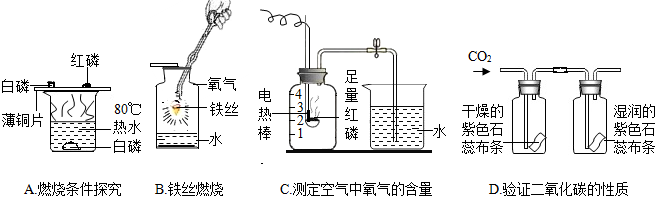
| A. | 水的作用是提供热量并隔绝空气 | |
| B. | 水的作用是防止溅落下来熔融物炸裂瓶底 | |
| C. | 实验结论是氧气约占空气体积的五分之一 | |
| D. | 实验可得出二氧化碳能使石蕊变红的化学性质 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Zn2+中的“2”表示锌原子带有2个单位的正电荷 | |
| B. | 2NO中的“2”表示2个一氧化氮分子 | |
| C. | H2CO3中的“2”表示一个碳酸分子中含有2个氢元素 | |
| D. | Al2($\stackrel{-2}{SO}$4)3中的“2”表示3个硫酸根离子的化合价为-2价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com