
【题目】氯化亚铜(CuCl)是一种白色粉末,不溶于水、乙醇(标准状况下沸点是78.2℃)及稀硫酸,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用于有机合成工业中的催化剂.以粗盐水(含氯化钙、硫酸镁等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺流程如下: 
(1)A溶液中溶质的化学式是;
(2)写出反应 III的化学方程式;
(3)反应 VI的化学方程式是:2NaCl+2CuSO4+SO2+2H2O=2CuCl↓+2H2SO4+Na2SO4 , 反应中化合价升高的元素是;
(4)本工艺中可循环利用的物质是;
(5)反应 VI后,过滤得到的CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却密封包装即得产品.70℃真空干燥的目的是 .
【答案】
(1)Na2CO3
(2)2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(3)硫元素
(4)NaOH、H2SO4
(5)加快乙醇和水的蒸发,防止CuCl被空气氧化
【解析】解:(1)加入氯化钡溶液可以除去硫酸根离子,加入碳酸钠溶液可以除去钙离子和过量的钡离子,加入氢氧化钠溶液可以除去镁离子,因此A溶液是碳酸钠溶液,碳酸钠的化学式是Na2CO3 . 故填:Na2CO3 . (2)反应III中,电解饱和食盐水时,氯化钠和水反应生成氢氧化钠、氢气和氯气,反应的化学方程式为:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑.
2NaOH+H2↑+Cl2↑.
故填:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑.(3)反应2NaCl+2CuSO4+SO2+2H2O=2CuCl↓+2H2SO4+Na2SO4中,氯化钠中钠元素的化合价是+1,氯元素的化合价都是﹣1,硫酸铜中铜元素的化合价是+2,硫元素的化合价是+6,氧元素的化合价是﹣2,二氧化硫中硫元素化合价是=4,氧元素化合价是﹣2,水中氢元素化合价是+1,氧元素化合价是﹣2,氯化亚铜中铜元素的化合价是+1,氯元素化合价是﹣1,硫酸中氢元素化合价是+1,硫元素的化合价是+6,氧元素的化合价是﹣2,硫酸钠中钠元素化合价是+1,硫元素的化合价是+6,氧元素的化合价是﹣2,因此反应中化合价升高的元素是硫元素,由+4变成+6.
2NaOH+H2↑+Cl2↑.(3)反应2NaCl+2CuSO4+SO2+2H2O=2CuCl↓+2H2SO4+Na2SO4中,氯化钠中钠元素的化合价是+1,氯元素的化合价都是﹣1,硫酸铜中铜元素的化合价是+2,硫元素的化合价是+6,氧元素的化合价是﹣2,二氧化硫中硫元素化合价是=4,氧元素化合价是﹣2,水中氢元素化合价是+1,氧元素化合价是﹣2,氯化亚铜中铜元素的化合价是+1,氯元素化合价是﹣1,硫酸中氢元素化合价是+1,硫元素的化合价是+6,氧元素的化合价是﹣2,硫酸钠中钠元素化合价是+1,硫元素的化合价是+6,氧元素的化合价是﹣2,因此反应中化合价升高的元素是硫元素,由+4变成+6.
故填:硫元素.(4)本工艺中可循环利用的物质是NaOH、H2SO4 , 电解生成的氢氧化钠可应用于反应Ⅰ,反应VI中生成的硫酸可应用于反应Ⅴ.
故填:NaOH、H2SO4 . (5)70℃真空干燥的目的是加快乙醇和水的蒸发,防止CuCl被空气氧化.
故填:加快乙醇和水的蒸发,防止CuCl被空气氧化.
【考点精析】掌握书写化学方程式、文字表达式、电离方程式是解答本题的根本,需要知道注意:a、配平 b、条件 c、箭号.


科目:初中化学 来源: 题型:
【题目】甲、乙两种物质的溶解度曲线如图所示.下列叙述正确的是( ) 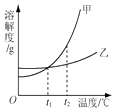
A.甲的溶解度比乙的大
B.将t2℃时甲、乙饱和溶液降温到t1℃,析出甲的质量大
C.t2℃时,等质量甲和乙的饱和溶液中所含溶剂的质量甲>乙
D.将t1℃时甲、乙饱和溶液升温的t2℃,溶液的溶质质量分数相等
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有一包由氧化铜、氢氧化铜、碱式碳酸铜组成的混合物5g,向其中加入50g溶质质量分数为9.8%的稀硫酸恰好完全反应,则该混合物中铜元素的质量分数为( )
A.50%
B.60%
C.64%
D.80%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种固体物质(不含结晶水)的溶解度曲线如图所示,下列说法正确的是( ) 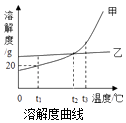
A.t2℃时,甲乙两物质溶液的溶质质量分数一定相等
B.要使接近饱和的乙溶液成为饱和溶液,可蒸发溶剂
C.分别将t2℃甲、乙两种物质的溶液降温至t1℃,一定都有晶体析出
D.t1℃时,50g甲的饱和溶液中溶解了10g的甲物质
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D是四种元素的原子结构示意图. 
(1)A元素位于元素周期表的第周期;
(2)决定D元素种类的数值是;
(3)具有相似化学性质的微粒是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com