
![]() 已知CaCl2 和Na2CO3能发生复分解反应,下列所示的图象能反映相对应实验的是
已知CaCl2 和Na2CO3能发生复分解反应,下列所示的图象能反映相对应实验的是
 |  | ||||
 | |||||
A.常温下向pH=13的NaOH溶液中不断加水稀释
B.向盐酸和氯化钙的混合溶液中加入碳酸钠
C.将60℃饱和的硝酸钾溶液加热蒸发水分至有白色晶体析出
D.将足量的金属镁片和锌片分别和等质量、相同质量分数的稀硫酸混合
科目:初中化学 来源: 题型:阅读理解
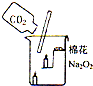 27、过氧化钠(Na2O2)是一种黄色固体.某次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入右图烧杯中,缓慢倒人CO2后发现处于下位的蜡烛先熄灭,上位的后熄灭,同时又惊奇的发现棉花燃烧起来.
27、过氧化钠(Na2O2)是一种黄色固体.某次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入右图烧杯中,缓慢倒人CO2后发现处于下位的蜡烛先熄灭,上位的后熄灭,同时又惊奇的发现棉花燃烧起来.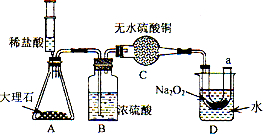
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com