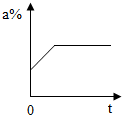
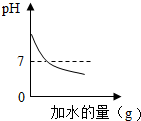
分析:A、溶液的PH<7,溶液显酸性,并且越小酸性越强;PH>7,溶液显碱性,并且越大碱性越强;PH=7,溶液显中性.pH=10的溶液显碱性,加水时碱性减弱,PH减小,PH接近7但到不了7;
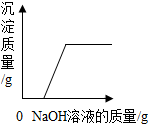
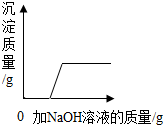
B、向H
2SO
4和CuSO
4混合液中滴加NaOH溶液时,两者都与NaOH发生反应,反应的化学方程式是:H
2SO
4+2NaOH═Na
2SO
4+2H
2O
CuSO
4+2NaOH═Cu(OH)
2↓+Na
2SO
4,因Cu(OH)
2能与酸反应,故该过程先发生酸碱中和,酸完全反应后,NaOH再与CuSO
4反应,才出现沉淀;
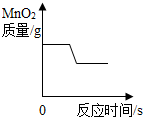
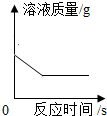
C、金属锌与稀硫酸反应:Zn+H
2SO
4=ZnSO
4+H
2↑,随着反应的进行,氢气质量增加,当稀硫酸完全反应时,氢气的质量不再增加;
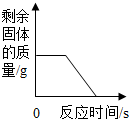
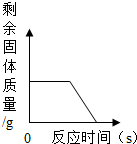
D、煅烧一定质量的石灰石,需要高温,因此需要一段时间后才能发生如下反应:CaCO
3 CaO+CO
2↑,剩余质量减少,但还有CaO剩余,故不能为0.
解答:解:A、溶液的PH<7,溶液显酸性,并且越小酸性越强;PH>7,溶液显碱性,并且越大碱性越强;PH=7,溶液显中性.PH=10的溶液显碱性,加水时碱性减弱,PH减小,PH接近7但到不了7.故A错误;
B、向H
2SO
4和CuSO
4混合液中滴加NaOH溶液时,两者都与NaOH发生反应,反应的化学方程式是:H
2SO
4+2NaOH═Na
2SO
4+2H
2O、CuSO
4+2NaOH═Cu(OH)
2↓+Na
2SO
4,因Cu(OH)
2能与酸反应,故该过程先发生酸碱中和,酸完全反应后,NaOH再与CuSO
4反应,才出现沉淀.故B正确;
C、金属锌与稀硫酸反应:Zn+H
2SO
4=ZnSO
4+H
2↑,随着反应的进行,氢气质量增加,当稀硫酸完全反应时,氢气的质量不再增加.故C错误;
D、煅烧一定质量的石灰石,需要高温,因此需要一段时间后才能发生如下反应:CaCO
3 CaO+CO
2↑,剩余质量减少,但还有CaO剩余,不能为0.故D错误.
故选:B
点评:解答该题的关键是关注实验的过程,在分析实验过程的同时,加强读图能力的提升,具有较强的综合性.



 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案