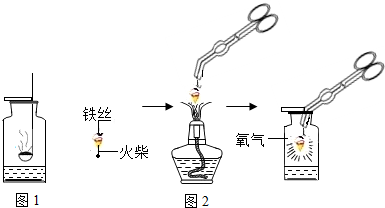
解:
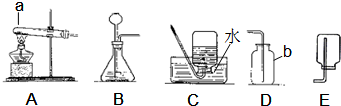
(1)图中仪器a是试管,b是集气瓶;故答案为:试管; 集气瓶;
(2)实验室制取二氧化碳是用大理石与稀盐酸反应,同时生成氯化钙和水,方程式是CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;二者反应不需加热,属于“固液常温型”,故可用发生装置B和G制取,二氧化碳密度比空气大且能溶于水,所以只能用向上排空气法收集;要得到干燥的二氧化碳气体,常用浓硫酸进行干燥;
故答案为:CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑; B或G; D; 浓硫酸;
(3)装置G中,若夹上弹簧夹,试管内氢气无法排出,造成试管内气压变大,就会将液体压入长颈漏斗,从而使酸液与塑料片上的锌分离,反应终止,而B中固体和液体一旦混合,不能使反应停止;故G与B相比,所具有的优点是:可以随时控制反应的发生和停止;
故答案为:与B相比,可以控制反应的发生与停止;
(4)氯酸钾在加热、二氧化锰作催化剂的条件下生成氯化钾和氧气,方程式是2KClO
3
2KCl+3O
2↑;该反应需要加热,属于“固体加热型”,故选发生装置A;氧气的密度比水小,若用盛满水的F装置收集氧气,故应从②通入;
故答案为:2KClO
3
2KCl+3O
2↑; A; ②;
(5)实验室用加热无水醋酸钠和碱石灰的固体混合物的方法制取甲烷,属于“固体加热型”,故发生装置选择A;甲烷难溶于水,故可用排水法收集,可选装置C或F,甲烷的相对分子质量为16,小于空气的平均相对分子质量29,故还可用向下排空气法收集;故答案为:AC或AF或AE.
分析:(1)依据常用仪器回答;
(2)依据制取二氧化碳的反应原理书写方程式;并依据反应物的状态和反应条件判断发生装置,依据气体的密度和溶解性判断收集装置;常用的液体干燥剂是浓硫酸;
(3)分析装置B和G的特点,判断装置G的优势;
(4)依据氯酸钾分解的反应原理书写方程式;并依据反应物的状态和反应条件判断发生装置,氧气的密度比水小,故应从②通入;
(5)依据反应物的状态和反应条件判断发生装置,依据气体的密度和溶解性判断收集装置.
点评:解答此题要掌握实验室制取气体装置选取方法,反应方程式等知识,并会灵活应用.


 2KCl+3O2↑;该反应需要加热,属于“固体加热型”,故选发生装置A;氧气的密度比水小,若用盛满水的F装置收集氧气,故应从②通入;
2KCl+3O2↑;该反应需要加热,属于“固体加热型”,故选发生装置A;氧气的密度比水小,若用盛满水的F装置收集氧气,故应从②通入; 2KCl+3O2↑; A; ②;
2KCl+3O2↑; A; ②;