
图是某试剂瓶标签上的内容。


(1)要把10g这种浓硫酸稀释为20%的硫酸,需要水的质量为 g。在用量筒量取水时若是仰视读数,将导致稀释后的硫酸溶液质量分数_________20%(“>”、“<”或“=”)
(2)试计算用上述稀释用的稀硫酸测定50gBaCl2溶液的质量分数,实验数据如右图所示,写出具体的计算过程。
(已知:BaCl2+H2SO4=BaSO4↓+2HCl )
(1)39; < (2)4.16%
【解析】
试题分析:(1)根据溶液稀释前后溶质的质量不变分析。
设需要加水的质量是x,则
10g×98%=(10g+x)×20%
解得,x=39g
在用量筒量取水时,若是仰视读数,则会导致实际量取的水的量比读数大,这将导致稀释后的硫酸溶液的质量分数小于20%。
(2)根据图象,可找出生成的沉淀的质量为2.33g,再结合化学方程式中氯化钡与硫酸钡的质量比,可计算出氯化钡的质量,进而求出50gBaCl2溶液的质量分数。
设该50gBaCl2溶液中BaCl2的质量为x,
BaCl2+H2SO4=BaSO4↓+2HCl
208 233
x 2.33g
208:x=233:2.33g
解得,x=2.08g
则该50g BaCl2溶液中BaCl2的质量分数=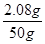 ×100%=4.16%
×100%=4.16%
答:50gBaCl2溶液的质量分数为4.16%。
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
点评:此题是关于化学方程式及溶质质量分数的计算题,要求学生有较强的识图能力和数据分析能力,解题的关键是根据图像,找出生成的沉淀的质量,并依据已知量对未知的应求量进行求解计算即可。


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案科目:初中化学 来源: 题型:阅读理解
| 浓硫酸(分析纯) 化学式:H2SO4 相对分子质量:98 密度:1.84/cm3 质量分数:98% |
| 阴离子 阳离子 |
OH- | NO3- | Cl- | SO42- | CO32- |
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 溶 | 不溶 | 不溶 |
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
| 除去碳酸钠 | 取少量该固体样品溶于水配成溶液,滴加适量的 |
有白色沉淀生成 | 有关反应的化学方程式为 |
| 检验是否含有氢氧化钠 | 在滤液中滴加酚酞溶液 | 该样品中含有氢氧化钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 如图是某试剂瓶标签上的内容.
如图是某试剂瓶标签上的内容.查看答案和解析>>
科目:初中化学 来源: 题型:
| 浓硫酸(分析纯) 化学式:H2SO4 相对分子质量:98 密度:1.84g∕cm3 质量分数;98%(1)把这种浓硫酸稀释为溶质质量分数是19.6%的硫酸溶液100g,需要这种硫酸的质量为 20g 20g (2)将稀释后的硫酸溶液与200g氢氧化钠溶液恰好完全反应,求氢氧化钠溶液的溶质质量分数. 查看答案和解析>> 科目:初中化学 来源: 题型: 如图是某试剂瓶标签上的内容.要把10g这种浓硫酸稀释为20%的硫酸,需要水的质量为 39 39 g.稀释浓H2SO4时,要将浓H2SO4 浓H2SO4 慢慢沿烧杯内壁 烧杯内壁 慢慢注入水 水 中,并用玻璃棒不断搅拌 用玻璃棒不断搅拌 .如果不慎浓硫酸沾到衣服上或手上,应立即用大量水 水 冲洗,然后涂上3%~5%的碳酸氢钠溶液 3%~5%的碳酸氢钠溶液 .
|