

分析 Ⅰ.(1)根据实验原理2Na2CO4+4HCl═4NaCl+2CO2↑+O2↑+2H2O,要测定氧气的量,必须先除去二氧化碳、氯化氢气体等,再根据实验装置图即可得出答案;
(2)根据二氧化碳和氢氧化钠反应生成碳酸钠和水进行分析;
(3)根据二氧化碳能使澄清石灰水变浑浊,可利用此现象鉴别二氧化碳;
(4)先求出氧气的质量,再根据化学方程式中氧气与过碳酸钠的质量关系,即可列比例求解出样品中的过碳酸钠的质量,那么样品的质量就应该大于这个质量;
Ⅱ.理论上可以根据生成二氧化碳的量求样品纯度,但是实际上难以通过实验测得纯净的二氧化碳的质量,因为反应前后装置②的质量差中还包括氯化氢和水蒸气的质量;所以难以求解;
Ⅲ.根据化学方程式中氯化钠与过碳酸钠的质量关系,即可列比例求解样品中的过碳酸钠的质量.
解答 解:Ⅰ.(1)装置④和⑤在实验中共同的作用是:测定生成的氧气体积;
(2)装置②中浓氢氧化钠的作用是除去二氧化碳和氯化氢气体,化学方程式为:CO2+2NaOH=Na2CO3+H2O;
(3)装置③中澄清石灰水的作用是验证二氧化碳是否被除尽;
(4)设收集到的氧气的体积为0.25L,需要过碳酸钠的质量为x,
2Na2CO4+4HCl═4NaCl+2CO2↑+O2↑+2H2O
244 32
x 0.25L×1.28g/L
$\frac{244}{x}$=$\frac{32}{0.25L×1.28g/L}$
x=2.44g
Ⅱ.测得二氧化碳的体积偏大,原因可能有:浓盐酸易挥发,产生的氯化氢气体被装置②吸收;二氧化碳气体逸出时带出的水蒸气在装置②中冷凝而被吸收;装置①、②内空气中的二氧化碳被装置②吸收;
Ⅲ.设样品中过碳酸钠的质量为y,
2Na2CO4+4HCl═4NaCl+2CO2↑+O2↑+2H2O
244 234
y 11.7g
$\frac{244}{y}$=$\frac{234}{11.7g}$
y=12.2g
该样品的纯度为:$\frac{12.2g}{12.5g}$×100%=97.6%.
故答案为:Ⅰ.(1)测定生成的氧气体积;
(2)CO2+2NaOH=Na2CO3+H2O;
(3)验证二氧化碳是否被除尽;
(4)2.44;
Ⅱ.ABC;
Ⅲ.97.6%.
点评 本题考查实验装置和混合物中样品纯度的计算.有关化学方程式的计算,要注意带入方程式计算的必须是实际参加反应或实际生成的物质质量,否则就会造成实验结果的偏大或偏小.


科目:初中化学 来源: 题型:填空题
 如表为我国生活饮用水国家标准的部分内容,请回答下列问题.
如表为我国生活饮用水国家标准的部分内容,请回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 73.5% | B. | 50% | C. | 88% | D. | 60% |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
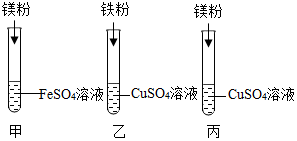 某小组同学要探究镁、铁、铜三种金属的活动性顺序,设计了如图所示的实验方案:
某小组同学要探究镁、铁、铜三种金属的活动性顺序,设计了如图所示的实验方案:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 如图所示装置有洗涤、收集和储存气体等多种用途(视实验需要,瓶中可装入不同物质),请填写下表,结合所学知识回答问题.
如图所示装置有洗涤、收集和储存气体等多种用途(视实验需要,瓶中可装入不同物质),请填写下表,结合所学知识回答问题.| 用途 | 气体或水入口(填A或B) | 瓶中物质 |
| ①除去H2中含有的少量HCl气体 | a | 水 |
| ②将水从导气管通入以取用瓶中储存的气体(氧气) | A | 氧气 |
| ③排水法收集有毒气体CO | B | 水 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 某品牌化肥标签如图所示,相关说法错误的是( )
某品牌化肥标签如图所示,相关说法错误的是( )| A. | 该化肥属于铵态氮肥,易溶于水 | |
| B. | 该化肥是由N、H、C、O四种元素组成的纯净物 | |
| C. | NH4HCO3能与碱性物质反应 | |
| D. | NH4HCO3受热可能会产生含氮元素的气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | $\frac{n}{64}$=$\frac{m}{80}$ | B. | $\frac{m-n}{16}$=$\frac{b}{44}$ | C. | $\frac{a}{28}$>$\frac{b}{44}$ | D. | a>$\frac{4}{5}$m |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 可燃物燃烧需要和氧气接触,且温度达到着火点 | |
| B. | 铁在干燥的空气中最容易生锈 | |
| C. | 铜和稀盐酸不能发生化学反应 | |
| D. | 点燃可燃性气体前需要检验气体的纯度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com