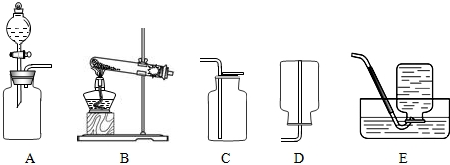
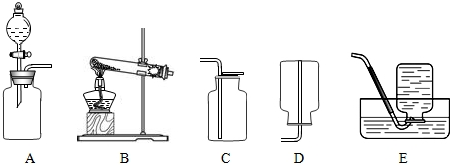
解:(1)①标号仪器分别是试管和集气瓶;
②二氧化锰在过氧化氢溶液分解中起催化作用,是反应的催化剂,能加快过氧化氢的分解速率;该反应不需加热,属于固液常温型,故选发生装置B,氧气的密度比空气大且不易溶于水,故可用向上排空气法或排水法收集,而不能用向下排空气法收集;
(2)①碳酸钙由钙离子和碳酸根离子构成,属于盐,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,方程式是:CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;
②A、滴加盐酸过快,会导致生成的CO
2不能完全被吸收,并被排出装置丙,所以缓慢地逐滴滴加盐酸,可使生成的CO
2完全被吸收,提高实验的测定准确度;
B、在甲乙间增添盛有浓硫酸的洗气装置,吸收水分,不影响CO
2,不影响实验的测定准确度;
C、在乙丙之间增添盛有饱和碳酸氢钠溶液的洗气装置Ba(OH)
2,可以吸收CO
2中的HCl,而不影响CO
2,故不影响实验的测定准确度;
D、反应结束后仍继续通入空气可使生成的二氧化碳被全部排出,影响CO
2的量,提高了实验的测定准确度;
③根据方程式CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑、CO
2+Ba(OH)
2═BaCO
3↓+H
2O可知物质间的关系如下,设碳酸钙的质量为x
CaCO
3→CO
2→BaCO
3↓
100 197
x bg
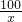
=

x=

所以碳酸钙的质量分数是:

×100%=

%
④乙中的水蒸气、氯化氢气体等进入装置丙中,导致测定二氧化碳的质量偏大,测定的碳酸钙的质量偏大,碳酸钙的质量分数偏高;
故答案为:(1)①试管;集气瓶;②催化作用;B;E;
(2)①盐;CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;②BC;③

;④乙中的水蒸气、氯化氢气体等进入装置丙中,使溶液增重.
分析:(1)①据常用仪器回答;
②二氧化锰在过氧化氢溶液分解中起催化作用,是反应的催化剂,并据反应物状态和反应条件确定发生装置,据氧气的密度和溶解性确定收集装置;
(2)①由金属离子和酸根离子组成的化合物是盐,并据碳酸钙和盐酸反应原理书写方程式;
②A、滴加盐酸过快,会导致生成的CO
2不能完全被吸收,并被排出装置丙;
B、在甲乙间增添盛有浓硫酸的洗气装置,吸收水分,不影响CO
2;
C、在乙丙之间增添盛有饱和碳酸氢钠溶液的洗气装置Ba(OH)
2,可以吸收CO
2中的HCl,而不影响CO
2;
D、反应结束后仍继续通入空气可使生成的二氧化碳被全部排出,影响CO
2;
③根据碳酸钡的质量求二氧化碳的质量,根据二氧化碳的质量求碳酸钙的质量,最后求质量分数,可利用方程式找出物质间的质量关系利用关系式求解;
④B中的水蒸气、氯化氢气体等进入装置C中会使溶液质量增加.
点评:本题能很好的考查学生对知识的掌握和应用,及分析、解决问题的能力,难度较大,要据相关知识结合具体情景仔细分析解答.



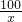 =
=

 ×100%=
×100%= %
% ;④乙中的水蒸气、氯化氢气体等进入装置丙中,使溶液增重.
;④乙中的水蒸气、氯化氢气体等进入装置丙中,使溶液增重.