
| 序号 | 实验现象或数据 | 结论 |
| 1 | 分别加热溶质的质量分数为1%的Na2CO3和NaHCO3溶液,观察气泡的生成可区分出这两种溶液 | |
| 2 | 用pH试纸测定一杯敞口久置于空气中的蒸馏水的pH为6 | |
| 3 | 配制溶质的质量分数为1%的澄清石灰水备用 | |
| 4 | 用排水法收满3瓶(每瓶250 mL)O2[ρ(O2)=1.43g/L],需称取的氯酸钾的质量为2.74g |
 2KCl+3O2↑
2KCl+3O2↑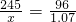 x=2.73≈2.74
x=2.73≈2.74

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:初中化学 来源: 题型:阅读理解
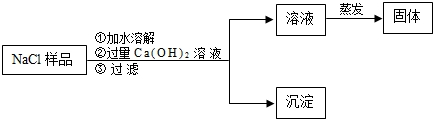
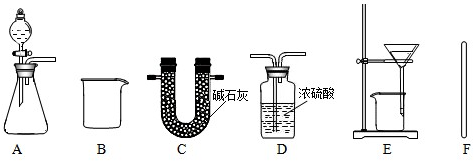
| 方案 | 药品 | 实装置 | 所需数据 (用ag、bg、cg、dg表示) |
Na2CO3的质量分数计算式 |
| 一 | D、E、F | |||
| 二 | ag、cg、dg | |||
| 三 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 混合气体 | 澄清的石灰水 | 浓硫酸 | 灼热的氧化铜 | 无水硫酸铜 | 澄清的石灰水 | 结 论 |
| A | 无现象 | 黑色变红色 | 白色变蓝色 | 变浑浊 | ||
| B | 黑色变红色 | CO2、H2 |
| 实 验 步 骤 | 实验现象 | 结 论 |
| 1.向盛该溶液的试管中加入足量稀HNO3 | 有气泡产生 | 证明有CO32- |
| 2.继续向试管中加足量 |
有白色沉淀生成 | 证明有 |
| 3.过滤,向滤液中加适量 |
有白色沉淀生成 | 证明有 |
查看答案和解析>>
科目:初中化学 来源:2010年天津市河东区中考化学一模试卷(解析版) 题型:解答题
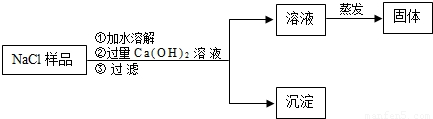

| 方案 | 药品 | 实装置 | 所需数据 (用ag、bg、cg、dg表示) | Na2CO3的质量分数计算式 |
| 一 | ______ | D、E、F | ______ | ______ |
| 二 | ______ | ______ | ag、cg、dg | ______ |
| 三 | ______ | ______ | ______ | ______ |
查看答案和解析>>
科目:初中化学 来源:2010年江苏省苏州市太仓市九年级质量调研化学试卷(解析版) 题型:解答题


| 方案 | 药品 | 实装置 | 所需数据 (用ag、bg、cg、dg表示) | Na2CO3的质量分数计算式 |
| 一 | ______ | D、E、F | ______ | ______ |
| 二 | ______ | ______ | ag、cg、dg | ______ |
| 三 | ______ | ______ | ______ | ______ |
查看答案和解析>>
科目:初中化学 来源:2009年北京市丰台区中考化学一模试卷(解析版) 题型:解答题
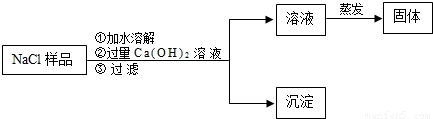

| 方案 | 药品 | 实装置 | 所需数据 (用ag、bg、cg、dg表示) | Na2CO3的质量分数计算式 |
| 一 | ______ | D、E、F | ______ | ______ |
| 二 | ______ | ______ | ag、cg、dg | ______ |
| 三 | ______ | ______ | ______ | ______ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com