
 ”和“
”和“ ”分别代表不同元素的原子,该反应可能是( )
”分别代表不同元素的原子,该反应可能是( )
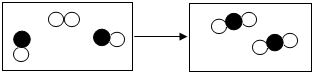 据此对相关的反应进行分析解答即可;
据此对相关的反应进行分析解答即可; ,所以该反应的特点是两个化合物的分子(不同原子的个数比是1:1)和一个单质的分子化合成2个化合物的分子(原子的个数比是2:1);
,所以该反应的特点是两个化合物的分子(不同原子的个数比是1:1)和一个单质的分子化合成2个化合物的分子(原子的个数比是2:1);
| ||
| ||
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
 (2013?宿迁)(1)请用化学符号表示:
(2013?宿迁)(1)请用化学符号表示:| +3 |
| Al |
| +3 |
| Al |
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
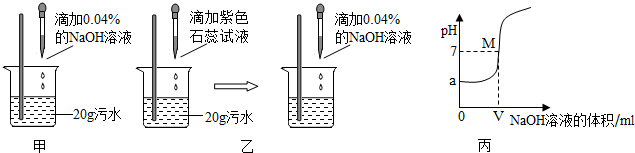
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| 53n |
| 50m |
| 53n |
| 50m |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com