
分析 (1)煤、石油和天然气属于化石燃料,是不可再生能源;二氧化硫、氮氧化物是形成酸雨的主要物质.
(2)液氢与液氧燃烧生成水,写出反应的化学方程式即可;
解答 解:(1)化石燃料包括煤、石油和天然气,它们属于不可再生能源;煤中含有硫,硫燃烧能生成二氧化硫,二氧化硫能和水反应生成亚硫酸,亚硫酸能和氧气反应生成硫酸,氮氧化物能和水反应生成硝酸等物质,当雨水中硫酸、硝酸等物质的含量达到一定程度时,就形成酸雨;
(2)液氢与液氧燃烧生成水,反应的化学方程式为2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O;
故答案为:(1)石油;NO2、SO2;(2)2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O.
点评 本题难度不大,环境污染日趋严重,已经引起人们的高度重视,治理污染初见成效,减少化石燃料的使用,大力开发利用新能源,有利于减缓环境污染;掌握氢气的化学性质、氢能源的优缺点等即可正确解答本题.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:初中化学 来源: 题型:解答题
| 质量分数 | 0.2% | 1% | 5% | 25% |
| pH | 11.3 | 11.6 | 12.0 | 12.3 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 黄曲霉素的相对分子质量为312 | |
| B. | 黄曲霉素有很强的毒性 | |
| C. | 黄曲霉素中碳、氢、氧三种元素的质量比为17:12:6 | |
| D. | 黄曲霉素是由碳、氢、氧三种元素组成的 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
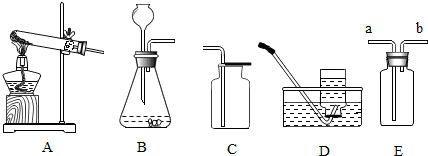
科目:初中化学 来源: 题型:解答题
 根据下列仪器回答有关问题.
根据下列仪器回答有关问题.查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 2NH4+:二个铵根离子 | |
| B. | H2O:一个水分子中含有一个氢分子 | |
| C. | Mg2+:一个镁离子带二个单位的正电荷 | |
| D. | $\stackrel{+2}{Cu}$O:氧化铜中铜元素的化合价为正二价 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com