加热氯酸钾和二氧化锰的混合物15克,使其完全反应.在一定温度下,向残留固体中加入4克水,有9.24克固体未溶解,再加入2克水,仍有8.28克固体未溶解,且剩余固体为混合物.
求:
(1)生成氧气的质量.
(2)此温度下,氯化钾的溶解度.
(3)原混合物中氯酸钾的质量.(精确到0.1)
【答案】
分析:氯酸钾在二氧化锰的催化下加热生成氯化钾和氧气,根据题意,经过两次加水溶解的剩余固体仍为混合物,说明了8.28克固体中有氯化钾和二氧化锰,两次加水形成的溶液为饱和溶液.2克水的水中溶解的氯化钾的质量为:9.24克-8.28克=0.96克,总共溶解氯化钾的质量为0.96克×3═2.88克,因此反应后混合物的总质量=2.88克+8.28克克=11.16克,根据质量守恒定律可以求出生成氧气的质量,由氧气的质量可以求出氯酸钾的质量;再根据饱和溶液中溶质、溶剂之间的关系可以计算出氯化钾的溶解度.
解答:解:(1)由题意可知,8.28g是氯化钾和二氧化锰混合物,两次加水形成的溶液为饱和溶液,2g水的水中溶解的氯化钾的质量为:9.24g-8.28g=0.96g,总共溶解氯化钾的质量为0.96g×3═2.88g,因此反应后混合物的总质量=2.88g+8.28g=11.16g,根据质量守恒定律,生成氧气的质量为:15g-11.16g=3.84g;
(2)设此温度下氯化钾溶解度为S
S:100g=0.96g:2g 解得:S=48g;
(3)设原混合物中氯酸钾的质量为X
2KClO
3 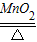
2KCl+3O
2↑
245 96
X 3.84g
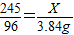
解得:X=9.8g
答:(1)生成氧气的质量是3.84克;(2)此温度下,氯化钾的溶解度是48克;(3)原混合物中氯酸钾的质量是9.8克.
点评:本题的关键是分析反应后物质的总质量,首先根据8.28克固体是混合物,说明氯化钾没有完全溶解,得到的溶液为饱和溶液,就可以推测溶解的氯化钾的质量.

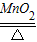 2KCl+3O2↑
2KCl+3O2↑ 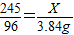 解得:X=9.8g
解得:X=9.8g 
