
【题目】现有生石灰、二氧化锰、铁、水、稀硫酸、苛性钠溶液、硝酸铜溶液、过氧化氢溶液,用以上物质按要求写出化学方程式(物质不能重复使用)
(1)分解反应__________________________________ ;
(2)化合反应__________________________________ ;
(3)置换反应___________________________________;
(4)中和反应___________________________________。
科目:初中化学 来源: 题型:
【题目】实验窒常会产生含硫酸的废水,需经处理至中性。某兴趣小组同学配制一定质量分数的氢氧化钾溶液来处理酸性废水。
(1)定性检测废水
检测废水呈酸性的方法是_____________。
(2)配制200 g质量分数为5.6%的氢氧化钾溶液
①计算
m (KOH)=_______g,V(H2O)=________mL(水的密度近似为1.0 g·mL-1)。
②称取氢氧化钾
调节托盘天平平衡后,将一只烧杯放在托盘天平的左盘,称量其质量。然后______(按操作先后顺序,填字母),直至天平平衡。
A.向烧杯中加氢氧化钾同体 B.按需要添加砝码、移动游码
③量取水;④溶解;⑤转移。
(3)定量测定废水
取酸性废水样品100 g,逐滴加入5.6%的氢氧化钾溶液,废水中硫酸的质量分数变化如右下图所示。(假设废水中其他成分不与氢氧化钾反应且不含硫酸钾)
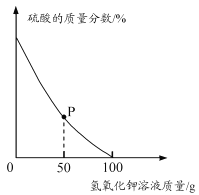
①P点对应溶液中一定存在的阳离子有_______(填离子符号)。
②酸性废水中硫酸的质量分数为______(用百分数表示,保留到0.1%)。
③计算当废水处理至中性时,溶液中硫酸钾的质量分数(写出计算过程,结果用百分数表示,保留到0.l%)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】电池是日常必备用品之一,但它也是环境污染的一个重要来源。是某兴趣小组利用废旧锌锰干电池作为原料,并进行相关探究的过程。
(知识储备)
(1)锌锰电池的构造和组成。
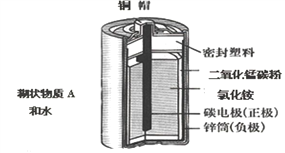
(2)结晶水合物的特殊性质:在逐步升高温度条件下,结晶水合物能失去部分或者全部结晶水,如蓝色的胆矾晶体(CuSO4 5H2O)受热时可失去结晶水变为白色的无水硫酸铜粉末(CuSO4)。
I.制备皓矾晶体(ZnSO4xH2O)
小组同学参观了某回收废旧锌锰电池的工厂,其回收工艺流程如下图:
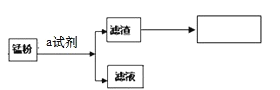
﹙1﹚流程图中试剂a的化学式是____________;得到的滤液1农业上可用作_____________。
﹙2﹚将滤渣B在空气中充分灼烧 可提纯制得的固体是____,该方法提纯的原理是(用化学方程式回答)______。
﹙3﹚将滤液2中溶质主要是硫酸锌,其有关溶解度和温度关系如下表,
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
将滤液2蒸发浓缩、_______________,可得到皓矾晶体(ZnSO4xH2O)。
II.皓矾晶体中结晶水含量的测定
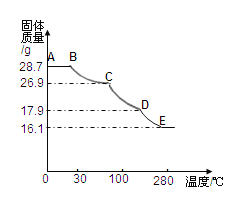
小组同学将部分皓矾晶体(ZnSO4xH2O)带回实验室,用下图装置测定晶体中结晶水的含量(图中半透膜可让气体通过又可防止固体粉末进入导管)。

测定方法:称取28.7g晶体置于C装置的硬质玻璃管中,加热至完全失去结晶水:(ZnSO4xH2O ==ZnSO4 + xH2O),冷却至常温后,称量玻璃管中固体其质量为16.1g。
⑷A中的化学方程式是____________,B中的试剂可从下列物质中选取,你的选择是_____
A.浓硫酸 B.硝酸银溶液 C.饱和碳酸钠溶液 D.澄清石灰水
⑸实验过程中若不通入CO2测得的结果将________(填“偏大”、 “偏小”或“无影响”)。根据实验结果,计算皓矾晶体中结晶水的x值为________。计算过程_____________。
⑹将上述皓矾晶体加热会逐渐失去部分结晶水,加热过程中有关残留固体质量如下图,写出D-E段发生反应的化学方程式______________ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】过氧化镁(MgO2)是一种镁精细化工产品。在医疗上可用来治疗消化不良、胃酸过多等疾病。在环境保护方面,过氧化镁可用来处理地下水污染的土壤。还可以用于牙膏,对牙齿有漂白和防过敏的作用。某化学兴趣小组对过氧化镁的性质和制备等进行了以下研究。
一.过氧化镁的性质
(1)过氧化镁(其中氧元素的化合价为 __________)是一种白色的粉末,其外观与物理性质与氧化镁相似。化学性质不够稳定,不溶于水,但逐渐的被分解放出氧气。过氧化镁有强氧化性,常温下比较稳定,但是加热时会分解生成氧气和氧化镁。请下出该反应的化学方程式____________。
(2)过氧化镁易溶于稀盐酸,发生反应:MgO2+2HCl=MgCl2+H2O2同时温度升高,说明该反应_______________热量(填“放出”或“吸收”)。
二.过氧化镁的制备
下图是利用碱式碳酸镁【Mg2( OH)2CO3】和30%的过氧化氢溶液来制取过氧化镁。
【资料】①碱式碳酸镁与碳酸镁有相似的化学性质,能与稀盐酸反应产生二氧化碳
②氧化镁与过氧化氢反应放出大量的热
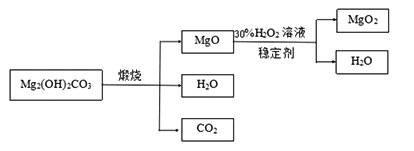
(3)检测煅烧过程碱式碳酸镁完全分解的方法是_________________(写出具体的操作和现象);上述生产过程加入稳定的剂的作用是_________________。
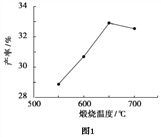
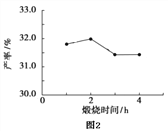
(4)用上述碱式碳酸镁在 550、600、650 及 700 ℃ 下煅烧一定的时间生成氧化镁。用上述条件制备的氧化镁分别与 30% 双氧水反应合成过氧化镁产率(见图1和图2)。碱式碳酸镁煅烧的温度适宜控制在______℃,煅烧的时间适宜控制在_____h。
(5)结果分析:在适宜的温度和时间下,碱式碳酸镁能完全分解,并且得到的氧化镁颗粒表面积最大,能与30%过氧化氢充分反应,所以产率高。推测700℃时,产率明显降低的可能的原因__________。
三.过氧化镁产品纯度检测
在生产过程中,过氧化镁中常常含有少量的氧化镁杂质(其他杂质不考虑),以下是该小组进行纯度检测的实验装置和实验步骤。
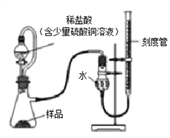
检查装置气密性,装入药品(样品质量为0.7g),调节刻度管使左右两边液面相平,刻度管度数为10.0mL。
打开分液漏斗开关,待瓶中无气泡产生时,关闭开关。
再次调节刻度管使左右两边液面相平,刻度管度数为122mL。
(6)稀盐酸中放入的少量硫酸铜溶液目的是__________________。
(7)根据上面实验数据计算样品中过氧化镁的质量分数__________(写出具体的计算过程,实验条件下O2密度为1.429g/L)。
(8)该小组同学所测得质量分数比实际结果偏大,你觉得可能的原因是(_______)
A.生成的氧气有少量溶于水 B.未等装置冷却到室温就开始读数
C.杂质与盐酸反应能产生少量的气体 D.滴入的稀盐酸占了一部分气体的体积
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学实验是学习化学的基础,根据给出的装置回答下列问题: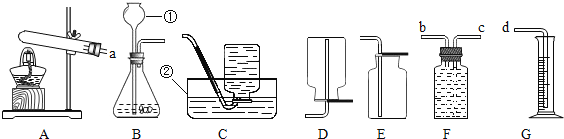
(1)仪器①的名称是_______________。
(2)实验室用一定质量的氯酸钾制取氧气,通过排水量测定所收集到的氧气体积.
①写出该反应的化学方程式________________________________________;
②若各装置借口的连接顺序是:a→b→c→d,则F装置内的导管(“b”或“c”)延伸方法是____
A.b导管口在液面上方,c导管口在接近瓶底 B.c导管口在液面上方,b导管口在接近瓶底
③根据氯化钾的质量依化学方程式算出的氧气体积为理论值。如果冷却到室温后,实际测得收集到的气体的体积大于理论值(水的体积测量准确)。你认为原因是_______________(写出一点即可)。
④若用加热高锰酸钾的方法制取氧气,装置A有一处不足,请改正___________________,目的是______________________________________。
(3)在上述⑵收集氧气的操作中,使用装置C,加热试管后导管口有气泡冒出,此时导管口还在集气瓶外面,接下来的操作正确的是_____________(填序号)。
①立刻将导管口移入集气瓶 ②等到气泡连续且均匀时,再将导管口移入集气瓶
③立即熄灭酒精灯,将导管口移入集气瓶后在点燃酒精灯。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是小明配制50g溶质质量分数为5%的NaCl溶液的有关实验操作示意图。
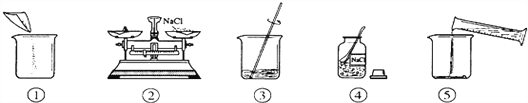
在实验室配制溶液时,常涉及以下过程:①溶解、②称量、③计算、④量取。请按要求回答问题:
(1)配制该溶液需NaCl______ g;水_______g。
(2)配制过程的先后顺序是_______(填序号)。小明操作有误的是_______(填序号),量取水最好选择_____的量筒(填序号①10mL、②50mL、③100mL)。(水的密度为1g/cm3)
(3)小明配制了50 g 5%的氯化钠溶液后,经检测,溶质质量分数偏小,其原因可能有__(填序号)。
①氯化钠固体不纯 ②量取水时,俯视读数 ③称量时砝码和食盐的位置放反了(1克以下用游码) ④用来配制溶液的烧杯内沾有水 ⑤量取水时,仰视读数 ⑥装瓶时,有少量溶液洒出
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】木糖醇是目前市场上一种理想的蔗糖替代品,在某些温度下其溶解度分别为:30℃时70g、50℃时84g,、60℃时90g.如图表示的是木糖醇等固体的溶解度曲线.根据曲线判断下列说法错误的是( )
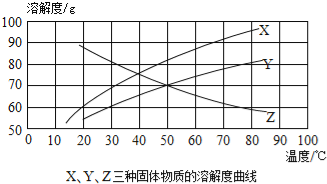
A. X为木糖醇的溶解度曲线
B. 随着温度的升高,Z物质的溶解度逐渐减小
C. 30℃时,X、Y、Z三种物质的饱和溶液中溶质质量分数最大的是Y
D. 50℃时,Y、Z两物质的溶解度相等
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是A.B两种物质的溶解度曲线,根据图示回答下列问题:
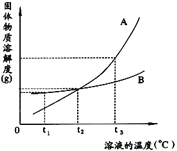
(1)t1℃时,向两只盛有100g水的烧杯中,分别加入A.B两种物质至不能溶解为止,所得溶液的溶质质量分数较大的是___________溶液(填“A”或“B”)。
(2)t2℃时,欲配制等质量的A.B两种物质的饱和溶液,所需水的质量关系是A___________B。 (填写“>”、“<”或“=”,下同)
(3)将t2℃的A.B两种物质的饱和溶液各200g,降温至t1℃,析出晶体的质量关系是A_______B。
(4)将t2℃的A、B两种物质的饱和溶液各200g,升温至t3℃,欲使它们仍为饱和溶液,若不改变溶剂质量,所需加入固体溶质的质量关系是A_______B。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】V2O3广泛应用于治金、化工等行业,实验室制取V2O3的流程如下:
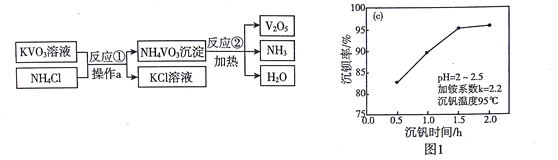
(1)KVO3中钒元素的化合价是_________
(2)操作a的名称是____________。图1表示反应①的沉钒率随时间变化的情况,为使生成沉淀的效率较高,反应①适合的时间是__________小时。
(3)反应②的化学方程式为____________,该反应的基本类型是________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com