
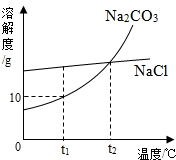
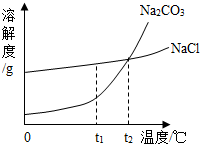
 我国北方有许多盐湖,湖水中溶有大量的Na2CO3和NaCl,那里的人们冬天捞碱(Na2CO3),夏天晒盐(NaCl).Na2CO3和NaCl的溶解度曲线如图所示.据图回答下列问题:
我国北方有许多盐湖,湖水中溶有大量的Na2CO3和NaCl,那里的人们冬天捞碱(Na2CO3),夏天晒盐(NaCl).Na2CO3和NaCl的溶解度曲线如图所示.据图回答下列问题:
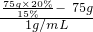 =25mL;由于仰视时量取的水要比实际需要的水的体积要大,即水量多了,因此所得溶液中溶质的质量分数偏小;故答案为:25,偏小
=25mL;由于仰视时量取的水要比实际需要的水的体积要大,即水量多了,因此所得溶液中溶质的质量分数偏小;故答案为:25,偏小

科目:初中化学 来源: 题型:
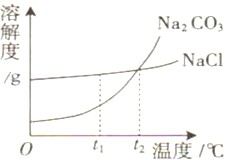 19、我国北方有许多盐湖,湖水中溶有大量的Na2CO3和NaCl,那里的人们冬天捞碱(Na2CO3),夏天晒盐(NaCl).Na2CO3和NaCl的溶解度曲线如下图所示,据图回答下列问题:
19、我国北方有许多盐湖,湖水中溶有大量的Na2CO3和NaCl,那里的人们冬天捞碱(Na2CO3),夏天晒盐(NaCl).Na2CO3和NaCl的溶解度曲线如下图所示,据图回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:
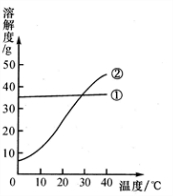 13、我国北方有许多盐湖,湖水中溶有大量的碳酸钠和氯化钠,那里的农民冬天捞碱(碳酸钠),夏天晒盐(氯化钠).
13、我国北方有许多盐湖,湖水中溶有大量的碳酸钠和氯化钠,那里的农民冬天捞碱(碳酸钠),夏天晒盐(氯化钠).查看答案和解析>>
科目:初中化学 来源: 题型:
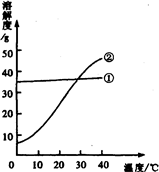 (2005?大连)我国北方有许多盐湖,湖水中溶有大量的碳酸钠和氯化钠,那里的农民冬天捞碱(碳酸钠),夏天晒盐(氯化钠).
(2005?大连)我国北方有许多盐湖,湖水中溶有大量的碳酸钠和氯化钠,那里的农民冬天捞碱(碳酸钠),夏天晒盐(氯化钠).查看答案和解析>>
科目:初中化学 来源: 题型:
 (2006?云南)结晶是分离可溶性固体混合物的一种常用方法.我国北方有许多盐湖,湖水中溶有大量的碳酸钠和氯化钠,那里的农民冬天捞“碱”(碳酸钠),夏天晒盐(氯化钠).请你判断图中能反映碳酸钠溶解度变化的曲线是( )
(2006?云南)结晶是分离可溶性固体混合物的一种常用方法.我国北方有许多盐湖,湖水中溶有大量的碳酸钠和氯化钠,那里的农民冬天捞“碱”(碳酸钠),夏天晒盐(氯化钠).请你判断图中能反映碳酸钠溶解度变化的曲线是( )查看答案和解析>>
科目:初中化学 来源:梅州 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com