
分析 根据氢氧化钠能够吸收空气中的水和二氧化碳,并且能和二氧化碳反应生成碳酸钠和水,碳酸钠能和盐酸反应生成氯化钠、水和二氧化碳,可溶性碳酸盐会与钙离子、钡离子等生产沉淀进行解答.
解答 解:氢氧化钠固体置露在空气中会出现吸水潮解现象;氢氧化钠能和空气中的二氧化碳反应,氢氧化钠和二氧化碳反应的化学方程式为:2NaOH+CO2═Na2CO3+H20;所以氢氧化钠质量会增大,可用稀盐酸或澄清石灰水等来检验是否变质,碳酸钠能和盐酸反应生成氯化钠、水和二氧化碳,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑或Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
故答案为:增大,吸水潮解,和二氧化碳反应,2NaOH+CO2═Na2CO3+H20,稀盐酸或澄清石灰水等,Na2CO3+2HCl═2NaCl+H2O+CO2↑或Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
点评 本题考查了氢氧化钠的性质,完成此题,可以依据已有的知识结合质量守恒定律的实质完成,注意检验碳酸根离子的方法是多样的,只要合理即可.


科目:初中化学 来源: 题型:选择题
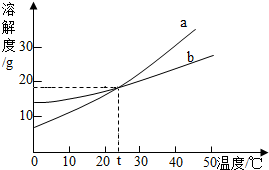 如图是a、b两种固体物质的溶解度曲线.从图中可获得的信息是( )
如图是a、b两种固体物质的溶解度曲线.从图中可获得的信息是( )| A. | 固体物质的溶解度均随温度升高而增大 | |
| B. | a物质的溶解度大于b物质的溶解度 | |
| C. | 降低温度,可使a或b的饱和溶液变为不饱和 | |
| D. | t℃,将相等质量的a、b分别加入100g水中,所得溶液的质量分数一定相等 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硫酸铜溶液和氢氧化钠溶液 | B. | 碳酸钠溶液与稀盐酸 | ||
| C. | 氢氧化钠溶液与稀盐酸 | D. | 硫酸钠溶液与硝酸钡溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
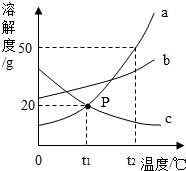 如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点.据图回答:
如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点.据图回答:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 同学们以盖房子的方式总结出了如下物质间的关系.A、B、C均为纯净物,且上、下相邻的物质间均可发生反应.回答下列问题.
同学们以盖房子的方式总结出了如下物质间的关系.A、B、C均为纯净物,且上、下相邻的物质间均可发生反应.回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 偏向右边 | B. | 偏向左边 | C. | 中间 | D. | 无法确定 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
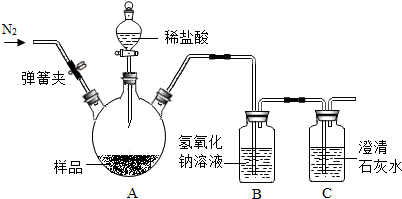 同学们在帮助老师整理实验室时,发现半瓶久置的氢氧化钙粉末[Ca(OH)2],大家决定用实验的方法探究这瓶粉末的组成.(资料:室温时,Ca(OH)2的溶解度是0.165g)
同学们在帮助老师整理实验室时,发现半瓶久置的氢氧化钙粉末[Ca(OH)2],大家决定用实验的方法探究这瓶粉末的组成.(资料:室温时,Ca(OH)2的溶解度是0.165g)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com