
| A | B | C | D | E | |
A | ↓ | ↓ | ↓ | ━ | |
| B | ↓ | ↑ | ━ | ━ | |
| C | ↓ | ↑ | ━ | ━ | |
| D | ↓ | ━ | ━ | ━ | |
| E | ━ | ━ | ━ | ━ |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题
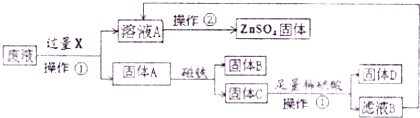
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 加热时间 | t1 | t2 | t3 | t4 |
| 剩余固体质量(g) | 2.12 | 2.08 | 2.04 | 2.04 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:单选题
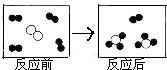

 分别表示X、Y、Z三种不同的气体分子,其在一定条件下反应前后的变化如图所示.下列叙述错误的是
分别表示X、Y、Z三种不同的气体分子,其在一定条件下反应前后的变化如图所示.下列叙述错误的是查看答案和解析>>
科目:初中化学 来源: 题型:解答题
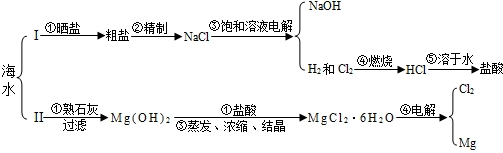
| OH- | Cl- | SO42- | CO32- | |
| Na+ | 溶 | 溶 | 溶 | 溶 |
| Ca2+ | 微 | 溶 | 微 | 不 |
| Ba2+ | 溶 | 溶 | 不 | 不 |
| Mg2+ | 不 | 溶 | 溶 | 不 |
| 配料表:氯化钠、食用碳酸钙、碘酸钾 净含量:500g 成分表:氯化钠≥88% 钙(以Ca计)(0.5-1.3)% 碘(以I计)(20-50)mg/kg |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com