已知X是地壳中含量较多的一种金属元素,在含有X元素的化合物(NH4)aXb(SO4)c?nH2O中NH4+和SO42-的质量比为3:16,X的质量分数为14.3%;a、b、c均为正整数,且a、b、c之和为5;该化合物7.84克与足量的熟石灰共热,充分反应后,生成的氨气恰好被含1.96克H2SO4的溶液全部吸收并生成正盐.
(1)推断a、b、c之值分别为a=______,b=______,c=______.
(2)推断X为何种元素,并确定该化合物的化学式(要求写出推算过程).
【答案】
分析:(1)根据NH
4+和SO
42-的质量比为3:16,得关系式
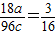
,根据a、b、c之和为5,得a+b+c=5,根据化合物中元素化合价的代数和为0,得(+1)×a+X的化合价×b+(-2)×c=0,再结合a、b、c均为正整数,X的化合价也为整数,得出a、b、c之值.
(2)根据化合物7.84克与足量的熟石灰共热,充分反应后,生成的氨气恰好被含1.96克H
2SO
4的溶液全部吸收并生成正盐,可得关系式:(NH
4)
2X(SO
4)
2?nH
2O~2NH
3~H
2SO
4,再根据关系式中化合物与硫酸的质量比得出关系式,结合X的质量分数得出的关系式计算X的相对原子质量,判断X的元素种类,同时求出n值,得出化学式.
解答:解:(1)因化合物(NH
4)
aX
b(SO
4)
c?nH
2O中NH
4+和SO
42-的质量比为3:16,则有
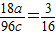
,即a=c;由于a、b、c之和为5,则a+b+c=5,又因化合物中元素化合价的代数和为0,
故(+1)×a+X的化合价×b+(-2)×c=0,即a+X的化合价×b-2c=0;又因a、b、c均为正整数,X的化合价也为整数;可得a=2,b=1,c=2.
(2)a=2,b=1,c=2,化合物的化学式为(NH
4)
2X(SO
4)
2?nH
2O,该化合物7.84克与足量的熟石灰共热,充分反应后,生成的氨气恰好被含1.96克H
2SO
4的溶液全部吸收并生成正盐,可得关系式:(NH
4)
2X(SO
4)
2?nH
2O~2NH
3~H
2SO
4,含1.96克H
2SO
4的溶液吸收的氨气应来自7.84克(NH
4)
2X(SO
4)
2?nH
2O,设X的相对原子质量为Ar则有
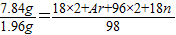
,即328=2Ar+36n,又由于X的质量分数为14.3%,则有

;
解两个方程组成的方程组得Ar=56,n=6,
X是地壳中含量较多的一种金属元素,应是铝或铁,所以X是铁.
所以化学式为:(NH
4)
2Fe(SO
4)
2?6H
2O.
故答案为:(1)a=2;b=1;c=2;
(2)(NH
4)
2Fe(SO
4)
2?6H
2O.
点评:化学计算是中考考查的重点和热点,是中考中必不可少的知识元素,对化学式的计算,要重点理解粒子数目比、元素质量比、相对分子质量的含义,对化学方程式的计算,要注意计算的格式和步骤.

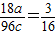 ,根据a、b、c之和为5,得a+b+c=5,根据化合物中元素化合价的代数和为0,得(+1)×a+X的化合价×b+(-2)×c=0,再结合a、b、c均为正整数,X的化合价也为整数,得出a、b、c之值.
,根据a、b、c之和为5,得a+b+c=5,根据化合物中元素化合价的代数和为0,得(+1)×a+X的化合价×b+(-2)×c=0,再结合a、b、c均为正整数,X的化合价也为整数,得出a、b、c之值.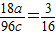 ,即a=c;由于a、b、c之和为5,则a+b+c=5,又因化合物中元素化合价的代数和为0,
,即a=c;由于a、b、c之和为5,则a+b+c=5,又因化合物中元素化合价的代数和为0,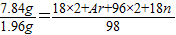 ,即328=2Ar+36n,又由于X的质量分数为14.3%,则有
,即328=2Ar+36n,又由于X的质量分数为14.3%,则有 ;
;

 阅读快车系列答案
阅读快车系列答案