
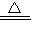 H2O+Cu,CO+CuO
H2O+Cu,CO+CuO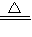 Cu+CO2,所以可以看出氧化铜固体减少的质量为氧元素的质量,而氢氧化钠的质量是吸收了水和二氧化碳,即固体质量减少的1.6g为氧元素,而且全部转化为水和二氧化碳中的氧元素,而水蒸气和二氧化碳,被氢氧化钠全部吸收的.氢氧化钠增重2.8g,即氢气和一氧化碳与氧化铜反应后生成的气体的质量为2.8g,也就是说我们要用1.2g的气体,结合1.6g的氧元素.根据化学方程式可以知道:如果全部是氢气,0.2g就可以结合1.6g氧元素,此时氢氧化钠只能增重1.8g;如果全部是一氧化碳,2.8g才可以吸收1.6g,此时氢氧化钠要增重4.4g,二氧化碳无法吸收,所以要想让氢气尽量的少,就要保证其他气体结合的氧元素尽量的多.那么显然的,二氧化碳一点都没有,效果的最好的.所以答案很显然为B.
Cu+CO2,所以可以看出氧化铜固体减少的质量为氧元素的质量,而氢氧化钠的质量是吸收了水和二氧化碳,即固体质量减少的1.6g为氧元素,而且全部转化为水和二氧化碳中的氧元素,而水蒸气和二氧化碳,被氢氧化钠全部吸收的.氢氧化钠增重2.8g,即氢气和一氧化碳与氧化铜反应后生成的气体的质量为2.8g,也就是说我们要用1.2g的气体,结合1.6g的氧元素.根据化学方程式可以知道:如果全部是氢气,0.2g就可以结合1.6g氧元素,此时氢氧化钠只能增重1.8g;如果全部是一氧化碳,2.8g才可以吸收1.6g,此时氢氧化钠要增重4.4g,二氧化碳无法吸收,所以要想让氢气尽量的少,就要保证其他气体结合的氧元素尽量的多.那么显然的,二氧化碳一点都没有,效果的最好的.所以答案很显然为B.

 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:初中化学 来源: 题型:
| A、H2、CO、CO2 | B、H2、CO | C、H2、CO2 | D、CO、CO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:单选题
查看答案和解析>>
科目:初中化学 来源:扬州 题型:单选题
| A.H2、CO、CO2 | B.H2、CO | C.H2、CO2 | D.CO、CO2 |
查看答案和解析>>
科目:初中化学 来源:2005年江苏省扬州市中考化学试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com