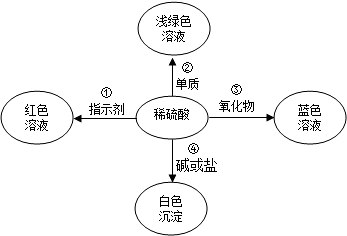
解:方案一:(1)用pH试纸测定溶液的pH的正确操作方法为:将pH试纸放在洁净的表面皿(或玻璃片)上,用玻璃棒蘸取少许待测液涂在pH试纸上,再与标准比色卡对照.
(2)根据实验过程及盐酸呈酸性的性质可以知道,强调“测得的pH小于7”的理由是为了排除是因为加入盐酸使溶液变稀而导致pH减小的因素;
方案二:(1)根据实验中“加热”目的和“滴入植物油”目的是为了防止溶液中溶入氧气或除去溶液中的氧气,从而表明酚酞溶液红色消失与空气中的氧气无关;
(3)①为了验证是否是碱的浓度过大而使溶液的红色消失,可以用浓度较小的氢氧化钠溶液来进行检验,即:取稀的氢氧化钠溶液溶液滴入酚酞溶液;
②观察到溶液的红色没有消失,所以可以判断氢氧化钠溶液的浓度影响颜色的变化;
方案三:(1)对比编号2中,氢氧化钠的质量分数是编号1的2倍,而3中盐酸和氢氧化钠都是1的2倍,共同作用应该是4倍,而温度变化也是4倍,所以编号2中温度变化应该是2倍,所以结论为7;
(2)氢氧化钠和盐酸发生中和反应,溶液的温度会升高,导致烧瓶内的压强增大,使U形管的液面出现高度差,考虑到烧瓶中的液体进入U型管中也会导致左侧的气体压强变大,所以也会使出现类似情况所以该同学的判断不一定准确;
(3)①仔细观察微观图象,我们知道反应前有H
2O、Na
+、Cl
-、H
+、OH
-五种粒子存在,反应后有H
2O、Na
+、Cl
-三种粒子存在,少了H
+、OH
-粒子,故反应消失的离子是H
+、OH
-;
②观察反应后的微观图形,可知水分子和氯化钠分子的个数比是8:1,故溶液中含有NaCl溶液溶质的质量分数为:
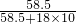
×100%=25%.
答:上图微观模型所反映的NaCl溶液溶质的质量分数为25%.
故答案为:方案一:(1)将pH试纸放在洁净的表面皿(或玻璃片)上,用玻璃棒蘸取少许待测液涂在pH试纸上,再与标准比色卡对照.
(2)排除是因为加入盐酸使溶液变稀而导致pH减小的因素;
方案二:(1)防止溶液中溶入氧气或除去溶液中的氧气.
(2)碱;无关;
(3)取稀的氢氧化钠溶液溶液滴入酚酞,观察到红色不再消失;
方案三:(1)7;
(2)U形管左侧液面降低;从分液漏斗内滴下的液体也会使烧瓶内气压增大而使U形管内出现液面差;
(3)①H
+和OH
-;
②28.9%.
分析:方案一:(1)根据用pH试纸测定溶液的pH的正确操作方法进行解答;
(2)简述强调“测得的pH小于7”的理由时考虑稀盐酸和稀释的作用.
方案二:(1)根据实验中“加热”目的和“滴入植物油”目的和实验结果表明酚酞溶液红色消失与空气中的氧气无关进行解答;
(3)①根据滴入酚酞溶液之后发现溶液呈现红色和酚酞遇碱性溶液变红的性质来进行解答;
②根据溶液的红色是否消失来进行判断;
方案三:(1)由表中数据,可推出x的值.
(2)某同学在没使用温度计的情况下,通过如图所示装置完成了实验.则该同学根据U形管中左边液面下降判断NaOH溶液与稀盐酸发生了中和反应,完成后一空的解答可以考虑到溶液的加入也会使气体的体积被压缩,可以据此解答;
(3)①根据左右两个容器中的粒子变化来进行解答;
②根据酸碱中和反应原理结合微观图象,计算溶质的质量分数.
点评:在做中和反应的实验时,由于酸和碱的溶液一般是无色,二者反应时的现象不明显,所以往往借助于一些试剂或仪器等(如酸碱指示剂、pH试纸、温度计等),来帮助我们判断反应是否进行或恰好完全.


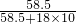 ×100%=25%.
×100%=25%.