
分析 (1)先计算出亚硝酸钠质量再除以每千克食品亚硝酸钠含量标准;
(2)根据质量守恒定律考虑.
解答 解(1)500g×30%=150g克,根据:$\frac{150克}{0.15克/千克}$=1000千克,所以至少可用于生产肉灌肠1000千克;
(2)A.NO2是红棕色有刺激性气味的气体,所以正确;
B.根据质量守恒定律,反应物中不能含氢元素,不会生成NH3,所以错误.
C.O2是无色无味的气体,所以错误;
D.根据质量守恒定律,反应物中不能含硫元素,不会生成SO2,所以错误.
故答为:(1)1000;(2)A.
点评 化学来源于生产、生活,也服务于生产、生活,与生产、生活相关的化学知识,关乎我们的生存、健康和社会的发展,是中考热点之一.


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 沉淀 | B. | 过滤 | C. | 吸附 | D. | 消毒 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 2014年5月7日,某公司在南京市进行探伤作业期间,丢失用于探伤的放射源铱-192一枚.据悉铱-192放射源会对人体造成损伤,严重的甚至死亡.元素周期表中“铱”的信息如图所示.下列关于铱元素说法正确的是( )
2014年5月7日,某公司在南京市进行探伤作业期间,丢失用于探伤的放射源铱-192一枚.据悉铱-192放射源会对人体造成损伤,严重的甚至死亡.元素周期表中“铱”的信息如图所示.下列关于铱元素说法正确的是( )| A. | 是一种非金属元素 | B. | 铱原子核内质子数为77 | ||
| C. | 铱原子核内一定有77个中子 | D. | 铱的相对原子质量为192.2克 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

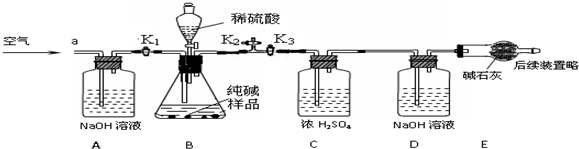
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com