
| x |
| 300g |
| 72g |
| 100g+72g |
| 90g-y |
| 300g-50g-36g-y |
| 46g |
| 100g+46g |
| 5×(16+1×2) |
| 64+32+16×4+5×(16+1×2) |
| 25g-8g |
| 25g+31g |
| a |
| 100g+a |


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:初中化学 来源: 题型:
| 取样地点 | 平均抽气次数(n) | 气体CO2的含量(体积) |
| 空旷的操场上 | 30 | 0.030% |
| 在刚下课的教室里 | 20 | ① |
| 汽车流量较大的车站旁 | 15 | ② |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 金属是现代生活和工业生产中应用极为普遍的一类材料.
金属是现代生活和工业生产中应用极为普遍的一类材料.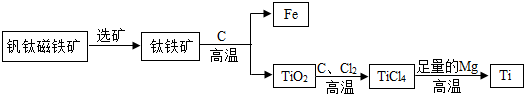
| 实验操作 | 实验现象 | 结论 |
| Ⅰ取少量的金属粉末于试管中,加入足量的 |
仅除去铝 | |
| Ⅱ将试管静置,弃去上层清液,加入足量的稀硫酸. | 证明含有铁 | |
| Ⅲ将试管静置,弃去上层清液,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
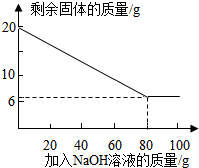 ②为探究该金属粉末中Al的质量分数,取20 g该金属粉末,把100 g氢氧化钠溶液平均分成5份依次加入,充分反应后,过滤出固体,将其洗涤、干燥、称量.实验过程中得到的部分数据与图象如下:
②为探究该金属粉末中Al的质量分数,取20 g该金属粉末,把100 g氢氧化钠溶液平均分成5份依次加入,充分反应后,过滤出固体,将其洗涤、干燥、称量.实验过程中得到的部分数据与图象如下:| 加NaOH溶液的次数 | 第一次 | 第二次 | 第三次 | … |
| 剩余固体的质量/g | 16.5 | n | 9.5 | … |
查看答案和解析>>
科目:初中化学 来源:北京期末题 题型:计算题
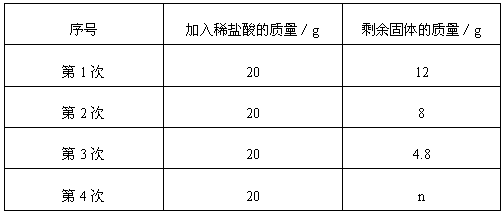
查看答案和解析>>
科目:初中化学 来源:专项题 题型:实验题





查看答案和解析>>
科目:初中化学 来源:厦门 题型:问答题
| 取样地点 | 平均抽气次数(n) | 气体CO2的含量(体积) |
| 空旷的操场上 | 30 | 0.030% |
| 在刚下课的教室里 | 29 | ①______ |
| 汽车流量较大的车站旁 | 15 | ②______ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com