
| 实验步骤 | 实验现象 | 实验结论 |
| 1、将皮蛋料泥的原料放入烧杯中,加适量的水搅拌、充分反应 | 试管外壁 ,有白色沉淀生成 | 滤渣中一定有 。 |
| 2、将上述烧杯中的物质过滤、洗涤,滤渣中滴加稀盐酸 | 有气泡冒出 | |
| 3、取少量滤渣于试管中加水充分溶解,取上层清液滴加 | 上层清液由无色变成红色 | |
| 4、取滤液三份,分别滴加酚酞、稀盐酸和通入CO2气体 | 溶液变红色、无明显现象、有白色浑浊 | 滤液中的溶质一定有 |


科目:初中化学 来源:不详 题型:单选题
| | 实验方案 | 结论 |
| A | 向盛装CO2的塑料瓶中加入NaOH溶液,观察到瓶身变瘪 | 说明CO2能与NaOH反应 |
| B | 木炭在空气和氧气中均能燃烧 | 说明氮气能支持燃烧 |
| C | 某红色粉末发生分解反应,只生成单质汞和氧气 | 该粉末由氧元素和汞元素组成 |
| D | 向紫色石蕊溶液中通入CO2,石蕊溶液变红 | CO2属于酸 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

| 探究目的 | 探究步骤 | 预计现象 |
| 除尽溶液中的CO32- | ①:取少量溶液于试管中,滴加足量的CaCl2试剂 | |
| 证明溶液中尚存NaOH | ②:向实验①过滤后所得溶液中滴加酚酞试液 | |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

| 温度(℃) | 10 | 20 | 40 | 60 | 80 | 100 |
| 溶解度(g/100g水) | 64 | 85 | 138 | 203 | 285 | 376 |


查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验步骤及操作 | 实验现象 | 实验结论 |
| 取样于试管中,加入足量蒸馏水振荡,静置 ①取上层清液,滴入无色酚酞试液 ②倒去上层清液,再向试管中注入稀盐酸 | ①无色酚酞试液变红 ② | 部分变质 |
| ①无色酚酞试液不变红 ② | | |
| ① ②没有气泡产生 | |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.关注物质的性质 |
| B.关注物质的变化 |
| C.关注物质的变化过程和现象 |
| D.关注探究活动设计和实验报告的格式 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

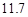 g NaCl和
g NaCl和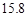 g NH4HCO3,理论上从溶液中析出晶体的质量为 g。
g NH4HCO3,理论上从溶液中析出晶体的质量为 g。| 物质 | NaCl | NH4HCO3 | NH4Cl | NaHCO3 |
| 溶解度/g |  | 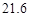 | 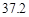 | 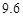 |
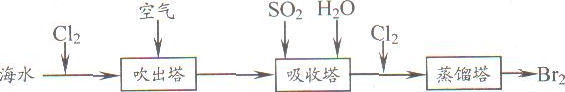
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
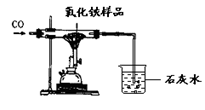
| | 反应前 | 氧化铁完全反应后 |
| A组 | 玻璃管和氧化铁样品的质量43.7g | 玻璃管和固体的质量41.3g |
| B组 | 烧杯和澄清石灰水的质量180g | 烧杯和烧杯中物质的质量186.8g |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

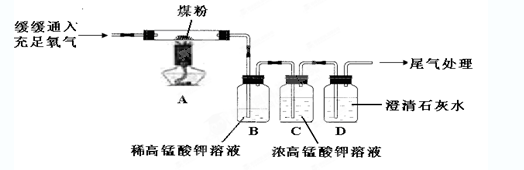
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com