某含铁样品5.6g与足量稀硫酸完全反应后产生氢气0.195g,则其所含杂质可能是( )
A.Na
B.Mg
C.Al
D.Zn
【答案】
分析:采用极值法先计算纯铁5.6g能生成氢气的质量,然后再确定杂质的类别.假设样品中全部是铁,计算一下5.6g铁能产生多少氢气,再与0.195g作比较,若计算值比0.195g大,说明混有的金属产生氢气的能力不如铁,或者说根本就不会产生氢气;若计算值比0.195g小,说明混有的金属产生氢气的能力比铁强.
解答:解:设纯铁5.6g能生成氢气的质量为x,则有
Fe+H
2SO
4=FeSO
4+H
2↑
56 2
5.6g x

=
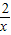
x=0.2g
设纯钠5.6g能生成氢气的质量为y,则有
2Na+H
2SO
4=Na
2SO
4+H
2↑
46 2
5.6g y

=

y≈0.24g
设纯镁5.6g能生成氢气的质量为z,则有
Mg+H
2SO
4=MgSO
4+H
2↑
24 2
5.6g z

=

z≈0.47g
设纯铝5.6g能生成氢气的质量为a,则有
2Al+3H
2SO
4=Al
2(SO
4)
3+3H
2↑
54 6
5.6g a

=

a≈0.62g
设纯锌5.6g能生成氢气的质量为b,则有
Zn+H
2SO
4=ZnSO
4+H
2↑,
65 2
5.6g b

=

b≈0.17g
根据平均值法,若是铁与钠或镁或铝的混合物,则生成的氢气质量应该大于0.2g,不可能为0.195g,故混有的杂质是锌.
故选D.
或者:
设该金属混合物为纯净金属M,其化合价为+2价,其相对原子质量为x.
M+H
2SO
4=MSO
4+H
2↑
x 2
5.6g 0.195g
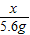
=

x=57.4
由于铁本身的相对原子质量为56,所以含有的杂质的相对原子质量大于57.4,所以含有的杂质为锌.故选D.
点评:本题考查了混合金属与酸反应生成氢气的质量关系,完成此类题目,可以首先采用极值法,然后采用平均值法进行.

 =
=
 =
=
 =
=
 =
=
 =
=
 =
=


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案