
【题目】铝土矿的主要成分是氧化铝(所含杂质不参与反应,也难溶于水),工业上用铝土矿制取金属铝的过程如下图所示,请你回答以下问题:
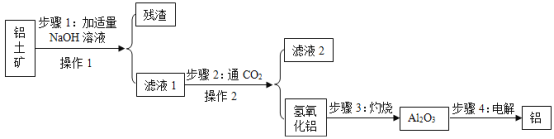
(1)步骤1中发生如下反应:Al2O3+2NaOH═2NaAlO2+X,X的化学式是__.
(2)操作1和操作2中均用到玻璃棒,其作用是__,滤液2的PH为10显__性(填“酸或碱”).
(3)步骤2得到的氢氧化铝可以用于治疗胃酸过多,该反应属于__反应(填“化合、分解、复分解”).
(4)步骤3中发生了分解反应,除了生成氧化铝,还有一种氧化物生成.请写出该反应的化学方程式__.
【答案】H2O 引流 碱 复分解 2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
【解析】
(1)根据化学反应前后原子的种类和数目不发生改变,在反应前铝原子有2个,钠原子有2,氧原子有5个,氢原子有2个,而反应后铝原子有2个,钠原子有2,氧原子有4个,氢原子没有,可判断物质X的每个分子由2个H原子构成、1个氧原子构成,则物质X的化学式为H2O;故填:H2O。
(2)操作1和操作2中均为过滤操作,用到玻璃棒,其作用是引流,滤液2的pH为10>7,显碱性;故填:引流;碱。
(3)步骤2得到的氢氧化铝可以用于治疗胃酸过多,它与胃酸反应的化学方程式是 3HCl+Al(OH)3═AlCl3+3H2O,该反应符合“两种化合物相互交换成分,生成另外两种化合物”的特点,属于复分解反应。故填:复分解。
(4)步骤3中灼烧发生分解反应,根据“除了生成氧化铝,还有一种常见的氧化物生成”,根据质量守恒定律,推测“一种常见的氧化物”为水,则该反应的化学方程式为2Al(OH)3![]() Al2O3+3H2O。故填:2Al(OH)3
Al2O3+3H2O。故填:2Al(OH)3![]() Al2O3+3H2O。
Al2O3+3H2O。


科目:初中化学 来源: 题型:
【题目】某混合溶液含有一定量的硝酸银、硝酸铜和硝酸钡,为逐一分离其中的金属元素,所加试剂均过量,且理论上氢氧化钠的消耗量最少。所加试剂1-3顺序正确的是
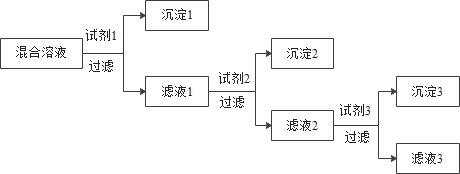
A.氢氧化钠、氯化钠、硫酸钠B.氯化钠、氢氧化钠、硫酸钠
C.氯化钠、稀硫酸、氢氧化钠D.硫酸钠、氯化钠、氢氧化钠
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种固体物质的溶解度曲线如下图所示。现将两支分别装有甲、乙两物质饱和溶液的试管(底部均有少量未溶解的固体)浸入盛有水的烧杯中,再向烧杯中加入一定浓硫酸。
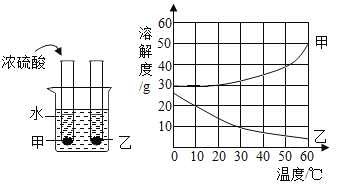
(1)50°C时,甲物质的溶解度是_____g。
(2)烧杯中加入浓硫酸后,甲、乙两试管中固体量的变化是_____。
(3)30°C时100g乙的饱和溶液中溶质的质量为_____g。(保留整数)
(4)根据溶解度曲线若想将含有少量甲的甲、乙的固体混合物一次分离,使滤液中含有最少量的乙,并得到乙的固体,你的具体操作是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】常见金属D的制取与转化关系如下(有些反应物和生成物已略去):
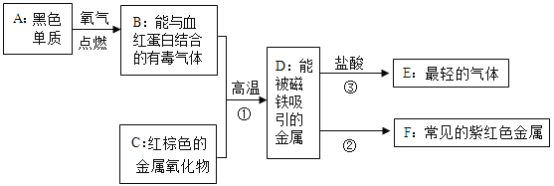
(1)请写出下列物质的化学式A:__;B:__;E:__.
(2)写出转化关系中①、②反应的化学方程式:
①__;②__.
(3)③的反应类型是__.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】前不久,PX项目在国内引起公众广泛的关注,PX的中文名是1、4﹣二甲苯,别名对二甲苯,化学式为C8H10.它是一种无色透明液体,有特殊的气味.下列有关说法不正确的是( )
A.对二甲苯碳元素与氢元素质量比为4:5
B.对二甲苯属于有机物
C.对二甲苯中碳元素的质量分数约为90.6%
D.对二甲苯的特殊气味属于物理性质
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学甲设计了如图1所示的实验验证质量守恒定律.
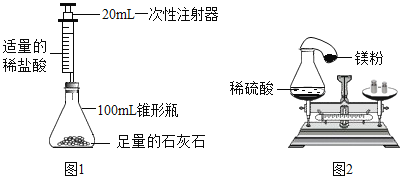
(1)按图1装配好仪器,检查装置的气密性的方法是_______;
(2)拔掉橡皮塞(注射器不要拔掉),装入足量石灰石,再用注射器吸入2mL的稀盐酸,注意盐酸不能多吸,原因是__________;
(3)再按图连接好装置,塞紧橡皮塞;
(4)将装置放在天平左盘,并用砝码游码使天平平衡;
(5)快速下推注射器活塞,使反应发生,此时锥形瓶内现象为_______、瓶外的现象为_______;
(6)反应结束后,再进行第2次称量,发现称量值没有发生变化;
(7)同学乙设计了如图2所示的装置来验证质量守恒定律,先把锥形瓶倾斜,再把气球中的铁粉倒入瓶中.试判断反应后,他的装置再次放在天平上_______(填“能”或“不能”)保持平衡.为什么________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氧是地壳中含量最多的元素。
(1)氧的原子结构示意图如图所示:
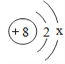
①x=________。
②氧原子在化学反应中易________(填“得到”或“失去”)电子。
(2)用化学用语填空:
①氧离子:___________; ②氧化镁:____________。
(3)在降温和加压的条件下,氧气由气体变成液体体积减少。用微粒的观点解释:___________。
(4)某变化的微观示意图如下所示。
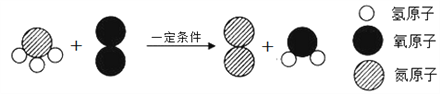
该反应的化学方程式为_________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用下图装置制取二氧化碳并进行性质实验。
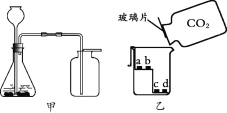
(1)锥形瓶中发生反应的化学方程式为______。
(2)甲中CO2验满的方法为______。
(3)乙中a、c为湿润的紫色石蕊试纸,b、d为干燥的紫色石蕊试纸。能说明CO2密度大于空气且能与水反应的现象是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请根据下列各图中的有关信息,回答下列问题:
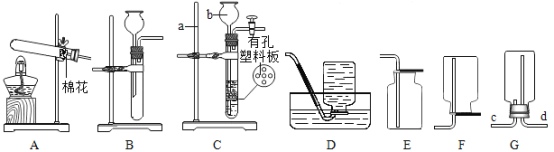
(1)仪器b的名称:_____。
(2)实验室用装置A制取氧气时发生反应的化学方程式是_____,若要收集到较纯净的氧气,应选用的收集装置是_____(填字母)。
(3)实验室制取二氧化碳的化学方程式为_____,若用G装置收集CO2气体,气体应从_____端(填“c”或“d”)进入。
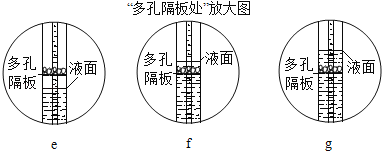
(4)若用C装置制取CO2,该装置的优点是_____;关闭开关后,C中多孔隔板处依次观察到的现象是_____(用字母e、f、g对如图进行排序)。
(5)某研究小组对H2O2分解的各种催化剂的催化效果进行定量对比探究。小组人员选用海藻酸钠(海藻酸钠是一种天然高分子物质,在本实验中性质稳定)作为催化剂支架,制备负载不同催化剂的海藻酸钠微球,利用数字化手持技术展开探究。
(实验过程)
I、制备五种负载不同催化剂(MnO2、Cr2O3、Fe2O3、CuO、S)的海藻酸钠微球,每个微球大小相同,且负载催化剂的质量相等。
II、取30粒负载某种催化剂的海藻酸钠微球与20mL质量分数为5%的过氧化氢溶液,在锥形瓶中迅速混合发生反应,实验装置如图1,采集200s内压强数据,绘制曲线如图2。
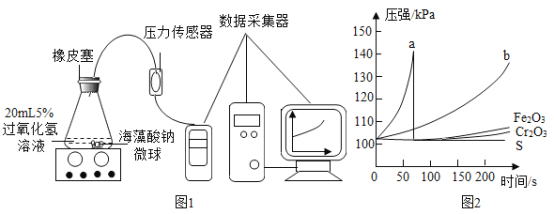
(实验分析)
①本实验中,负载MnO2的微球显示了良好的催化效果,图2中对应的曲线是_____(填“a”或“b”);写出该曲线对应的化学方程式_____。
②a瓶在60秒左右时压强突然恢复到常压,最可能原因是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com