23、某研究性学习小组对“SO
2能否与H
2O反应生成酸”进行探究.请你参与他们的探究活动,并回答有关问题.
(1)查阅资料:①SO
2常温下是一种无色气体,易溶于水;②酸能使蓝色石蕊试纸变成红色;③SO
2有毒.
(2)提出假设:SO
2能与H
2O反应生成酸.
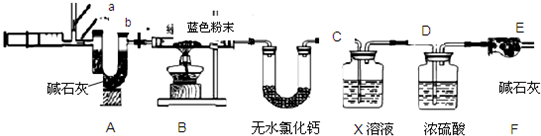
(3)实验探究:设计如右图所示装置进行实验.
①实验过程中,A装置内蓝色石蕊试纸的颜色始终没有变化.A装置的作用是
证明SO2不能使蓝色石蕊试纸变色
.
②在通入SO
2之前将B装置中胶头滴管内的蒸馏水滴到蓝色石蕊试纸上,未见试纸颜色发生变化,此步操作的目的是
证明水不能使蓝色石蕊试纸变色
.当有SO
2通过时发现湿润的蓝色石蕊试纸变红,此现象说明
SO2与水反应生成酸
,此过程中反应的化学方程式为
SO2+H2O=H2SO3
.
(4)结论:原假设成立.
(5)反思与评价:该实验方案中,有一个明显的疏漏,请你帮他们指出不足之处
尾气没有处理
.
(6)拓展探究:该研究性学习小组取刚降到硫酸厂(生产过程中产生SO
2)附近的雨水进行测定,每隔几分钟测一次pH,其数据如下表所示:

分析上述数据的变化,你可得出的结论是
随着时间的变化,雨水的酸性逐渐增强
;针对此结论,你猜测其中的原因为
H2SO3与空气中的O2反应生成了H2SO4
.结合大理石雕像受到酸雨腐蚀的事实,你认为碳酸、硫酸、亚硫酸(H
2SO
3)酸性由强到弱的顺序是
H2SO4>H2SO3>H2CO3
.

 23、某研究性学习小组对“SO2能否与H2O反应生成酸”进行探究.请你参与他们的探究活动,并回答有关问题.
23、某研究性学习小组对“SO2能否与H2O反应生成酸”进行探究.请你参与他们的探究活动,并回答有关问题.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案